Поширення та використання оксидів. Ушакова Л.В. Чкалівська ЗОШ I-III ступенів
Навчальна мета: узагальнити і розширити знання учнів про оксиди; розглянути поширення оксидів у природі, приклади їх використання, розвивати інтерес до вивчення фізики та хімії, розширювати їх світогляд;
Розвивальна мета: продовжити формування інформаційно-комунікативних умінь учнів: вибирати потрібну інформацію, аналізувати її й робити відповідні висновки; представляти міні - дослідження з цієї проблеми у вигляді презентацій, буклетів тощо;
Виховна мета: формування світогляду учнів, розвиток мовлення, мислення(уміння аналізувати й узагальнювати, робити висновки); показати роль знань цієї теми для практичних потреб людини.
Поширення та використання оксидів.
Ушакова Л.В. Чкалівська ЗОШ I-III ступенів
Цільова група: 8 клас
Тривалість: 45 хвилин.
Навчальна мета: узагальнити і розширити знання учнів про оксиди; розглянути поширення оксидів у природі, приклади їх використання, розвивати інтерес до вивчення фізики та хімії, розширювати їх світогляд;
Розвивальна мета: продовжити формування інформаційно-комунікативних умінь учнів: вибирати потрібну інформацію, аналізувати її й робити відповідні висновки; представляти міні - дослідження з цієї проблеми у вигляді презентацій, буклетів тощо;
Виховна мета: формування світогляду учнів, розвиток мовлення, мислення(уміння аналізувати й узагальнювати, робити висновки); показати роль знань цієї теми для практичних потреб людини.
Операційні цілі: після закінчення уроку здобувачі освіти:
- можуть проводити дослідження, працювати з різними джерелами інформації спостерігати, аналізувати та узагальнювати, проводити досліди, створювати моделі, буклети, презентації.
- розуміють залежність між складом, властивостями та застосуванням оксидів в побуті й у промисловості;
- знають значення оксидів, їх використання в різних галузях промисловості, у побуті, як застосувати знання з хімії і фізики для вибору майбутньої професії, негативний вплив оксидів на навколишнє середовище і здоров’я людини.
Тип уроку: узагальнення й систематизація знань.
Форма проведення: урок –дослідження.
Методи та техніки: STEAM-технології, мозковий штурм, розповідь, аплікаційний скрайбінг демонстрація, метод конкретних ситуацій(кейс – метод), прийом «Проблемне питання», роздавальним матеріалом, самостійна пошукова діяльність, робота в групах, синтез думок, аналіз рішень, методи контролю і самоконтролю, використання ТЗН, фотоколаж.
Обладнання: періодична система хімічних елементів Д.І.Менделєєва, комп’ютерні технології, колекція «Оксиди», проектор, розробка презентації, опорні конспекти, картки для індивідуальної роботи, підручник для 8 класу загальноосвітніх навчальних закладів (автор – П.П. Попель, Л. С. Крикля). Реактиви: зразки оксидів (кальцій оксид, алюміній оксид, манган (IV) оксид, хром (III) оксид, купрум (II) оксид, вода, нітроген (IV) оксид), кальцій оксид, кольоровий папір, фломастери, акварельні фарби, пробірки, лабораторний штатив, спиртівка, кулестрижневі моделі молекул.
Хід уроку.
І. Організаційний етап
1. Створення позитивного настрою (1хв.)
Доброго дня діти. Приготуйтесь до уроку. Покладіть на край парти все те, що необхідно буде для уроку. Погляньмо один на одного, посміхнімося. Сьогодні у нас незвичайний урок, на уроці присутні багато гостей. Але як водиться в гарному домі, гості відпочивають, а господарі – працюють, тож і ми з вами почнемо працювати! Я вам бажаю бути творчими, спокійними і мати гарний настрій. Чекаю від вас плідної праці.
Учитель. «Просто знати - це ще не все, знання потрібно використовувати» (І.Гете).
ІІ. Мотивація навчальної діяльності (3 хв)
Ви вже другий рік подорожуєте по надзвичайній країні Хімії. І кожного разу, на кожному уроці, виявляється, що ми знаємо з вами так мало. Як сказав Сократ: «Я знаю, що нічого не знаю!», бо кожний раз ми пізнаємо щось нове, зустрічаємо та знайомимося з новими мешканцями цієї казкової країни. Уявімо, що ми у якомусь науково-дослідному інституті, де є лабораторія хімії та фізики. Сьогодні ми не просто учні, а справжні дослідники.
«Хімік без знання фізики подібний до людини, яка все повинна шукати навпомацки. І ці дві науки так з’єднані між собою, що одна без іншої досконалою бути не може» М.В. Ломоносов.
Сьогодні ми поєднаємо дві такі чудові науки про природу - фізику і хімію під час вивчення нового матеріалу.
1. Розподіл учнів: на домашні групи-лабораторії за інтересами до предмета хімії чи фізики.
- клас поділяється на 2 групи-лабораторії, кожна з яких складається з 10учнів( капітан – зачитує завдання, організовує роботу, підбиває підсумки; секретар – веде записи результатів своєї групи, висловлює свою думку під час підбиття підсумків; доповідачі - висловлюють думку групи, доповідають про результати роботи; спостерігачі – стежать за часом, заохочують групу до роботи; фізик і хімік - лаборанти – проводять досліди).
- За тиждень до уроку учні отримують випереджувальні завдання для створення буклетів та презентацій про поширення і застосування оксидів.
2.Вправа «Правила».
Учитель хімії. У наших лабораторіях ми з вами маємо дотримуватись певних правил. (Учні відповідають: правила техніки безпеки, також правила роботи в групах: не перебивати один одного, допомагати, поважати, слухати і бути активними)
ІІІ. Актуалізація опорних знань ( 10хв.)
Учитель хімії. Хіба може людина зайти в лабораторію нічого не знаючи і щось починати робити? Хоча б орієнтуватися треба. А зараз ми з’ясуємо такі питання.
1. Вправа «Мозковий штурм»
1. Які класи неорганічних сполук ви вивчили ?
2. Що таке оксиди ?
3. Що таке основи?
4. Що таке кислоти?
- Що таке солі?
6. На які групи поділяються оксиди ?
7. Які оксиди вам зустрічаються у побуті ?
8. В яких агрегатних станах може бути вода ?
- Вода у цих трьох станах має однакову чи різні формули ?
- Які оксиди є найпоширенішими?
2. Вправа «Пазли»
Кожна група отримує пазли із формулами речовин, та складає відповідно до запропонованого завдання. (Запис на дошці, клеїмо стікерами формули).
1 група – знайти і назвати оксиди неметалічних елементів.
2 група – знайти і назвати оксиди металічних елементів
З'ясуйте, чого більше: оксидів металічних чи неметалічних елементів: КОН, СаО, CО, Н2S, Fе2О3, О2, КОН, CuO, НNО3, Н2О, НС1, Р2О3, СО2, K2SO4, NО2, СаСО3, FeО, BaO, SO2, Cr2O3, H2SO3. Бажаю успіхів кожній групі.( Відповідь Неметалічні оксиди: CО, Н2О, Р2О3, СО2, NО2, SO2; металічні оксиди: СаО, Fе2О3, CuO, FeО, BaO, Cr2O3).
- Деякі оксиди замаскувалися під різними назвами: іржа, негашене вапно, сухий лід, лисячий хвіст, вода, чадний газ. Допоможіть встановити їхнє хімічне ім'я.
Учитель хімії. Ось ми зробили перший крок. На попередньому уроці ви отримали випереджувальні пошукові завдання: виготовити інформаційні буклети про оксиди, прошу поставити їх на загальний стіл. Сподіваюсь, вони нам допоможуть. (На буклеті написана формула оксиду і коротка інформація про нього: де поширений, як застосовується і т.п.)
ІV. Основна частина (10хв.)
Учитель хімії. Сьогодні ми продовжимо мову про добре відомі вам речовини (групи отримують текст, читають і знаходять тему уроку). «Батьківщиною хімії вважають Єгипет. Ця найдавніша країна світу розташована у самому серці Лівійської пустелі. Навколо сухий сипучий пісок. І раптом, о диво! Зелені поля, стрункі пальми, повсюди вирує життя. То несе свої хвилі життєдайний Ніл – основне джерело води. Дощ тут рідкісне явище. І що цікаво: якщо в Україні дощ вважається небесною благодаттю, то в Єгипті дощ, злива сприймається як страшне лихо. Воно й зрозуміло – будинок простого єгиптянина побудований з глини. Під час дощу глина розкисає й будинок руйнується». (Це оксиди, які утворюють речовини: воду, пісок, глину.)
Учитель хімії. Що ми про них знаємо? Чого ще нам не відомо про них? (Поширення оксидів та використання людиною.) Відкриваємо зошити і записуємо число і тему нашого уроку.
«Поширення та використання оксидів.»
1.Вправа «Очікування». Вибір рішення проблеми, планування роботи.(3хв)
Учитель. Сучасне життя вимагає компетентних спеціалістів у всіх сферах. Щоб бути сучасним спеціалістом, потрібно перед собою ставити чітко мету і йти до неї долаючи всі труднощі.
Вправа « Мікрофон»
Діти чого ви чекаєте від уроку? Кожен учень має визначити свої очікувані результати від сьогоднішнього уроку – дослідження, записати їх на листочках ( вирізані з кольорового паперу заздалегідь) та залишити на гілочці, яка прикріплена до дошки. (Відповіді: об’єднати знання з хімії та фізики про оксиди; дізнатись, які оксиди зустрічаються найчастіше; дізнатися, які із оксидів найбільше використовує людина). Я очікую від вас співпраці, взаєморозуміння, уміння спостерігати, робити висновки, узагальнювати. Сьогодні ви будете працювати із опорними конспектами, куди ви будете записувати основні відомості із даної теми. У вас на партах лежить листок самооцінювання, для фіксування отриманих балів на уроці.
2. Дослідження: члени лабораторій вивчають потрібну інформацію із даної теми, використовуючи різні джерела інформації.
Учитель хімії : Пам’ятайте! «Чого б Ви не навчилися - Ви навчаєтесь для себе». Ці слова видатного філософа Петронія будуть девізом нашого сьогоднішнього уроку.
Зараз саме час використати ваші буклети і презентації.
2.1Дослідження перше «Поширення оксидів у природі».
Виступ учнів(3хв) . Демонстрація слайдів:
Оксиди містяться в кожній із трьох оболонок нашої планети – в атмосфері, гідросфері, літосфері.
Найпоширенішими оксидами в атмосфері є (СО2 CO, SO2, Н2О NO2); в гідросфері (вода Н2О ), а в літосфері – силіцій(IV) оксид SiO2 (мінерал кварц, складова піску). Найбільше оксидів трапляється в літосфері. Вони входять до складу гірських порід, ґрунтів, мінералів.
Завдання для учнів: Використовуючи лабораторний набір моделей атомів зробити кулестрижневі моделі оксидів, і довести, що це оксиди.(Всі оксиди складаються з двох елементів, один з них Оксиген)
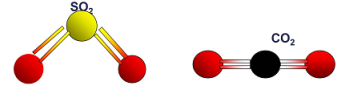
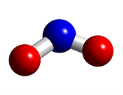 Н2О NO2
Н2О NO2

 Учитель хімії: Давайте разом підіб’ємо підсумки цієї роботи та запишемо поширення оксидів у вигляді опорної схеми. Один учень запрошується до дошки. (Застосування аплікаційного скрайбінгу)(2хв.)
Учитель хімії: Давайте разом підіб’ємо підсумки цієї роботи та запишемо поширення оксидів у вигляді опорної схеми. Один учень запрошується до дошки. (Застосування аплікаційного скрайбінгу)(2хв.)
Учитель хімії: Мабуть, ви вже всі втомилися. Пропоную хвилинку відпочити.
Динамічна пауза(2 хв.) (Проводить учень)
Ми оксиди зараз вчили
І ми трішечки втомились
Треба пальці розім’яти
Руки вгору підійняти
Обернутися довкола
Посміхнутися навколо
І в долоні зробим, «хлоп»
І знову сядем за урок!
3.Практична перевірка теоретичних знань та припущень.(15хв.)
Учитель хімії: Дійсно, оксиди це ті речовини, з якими ми контактуємо щодня. Мабуть важко переоцінити значення сполук, які ми сьогодні вивчаємо, для нашої планети та для людини. Вивчаючи оксиди ми можемо потрапити до майстерні художника, маємо змогу зазирнути на кухню, в аптеку, промислове підприємство та екологічну інспекцію – і все це за один урок, не виходячи з кабінету хімії.
= Висування проблеми = Від чого залежить широкий спектр використання цих сполук? (Відповідь: від різноманітності їх фізичних і хімічних властивостей, і від того, з яких частинок вони складаються – атомів, йонів чи молекул. Оксиди металів, мають не молекулярну будову, вони тверді, оксиди неметалів, мають молекулярну будову, вони рідкі, газуваті.)
3.1.Дослідження друге. Ситуаційна вправа(осмислення реальної життєвої ситуації).

 Учитель хімії. Запрошую вас переглянути слайди з акварельними малюнками .
Учитель хімії. Запрошую вас переглянути слайди з акварельними малюнками .
У вас на столах знаходять акварельні фарби, у хіміків хімічні склянки з певними оксидами (або формули оксидів).
Наступне завдання: з’ясувати, які фізичні властивості і яких оксидів використовує людина для створення малюнків, як фізики і хіміки пояснюють утворення кольорів?
Нагадую про дотримання правил безпеки життєдіяльності. Поводьтесь з речовинами обережно. Один учасник групи повинен буде коротко донести встановлену інформацію. На це завдання маєте (5 хв).
Відповіді учнів. Доповідач-хімік.
Для кольорових акварелей часто використовують такі фарби:
- охри (від грец. «охрос» «блідий», «жовтуватий») містить ферум (ІІІ) оксид;
-умбра містить манган (IV) оксид барвник коричневого кольору;
-залізний сурик - пігмент темно-червоного кольору - це ферум (III) оксид з домішками силікату алюмінію і кварцу - силіцій(IV) оксиду.
Доповідач –фізик. Працювати акварельними фарбами рекомендується при денному світлі, тому що при штучному освітленні кольорові тони сприймаються інакше (особливо зелені і жовті). Основні її властивості: це прозорість і легкість, чистота і інтенсивність фарби. Ці її властивості обумовлюються перш за все тим, що шари фарби, що наносяться на папір, завжди тонкі, а тому прозорі для проникаючого через них проміння світла. Учитель хімії: Давайте разом підіб’ємо підсумки цієї роботи. Які властивості оксидів використанні людиною для створення фарб? ( Відповідь. Колір деяких металічних елементів у складі оксидів забезпечив застосування оксидів у виготовленні різноманітних фарб.)
3.2.Дослідження третє. Застосування оксидів.
Презентація буклетів фізиків та хіміків про застосування оксидів металів та неметалів.(5хв)
Учитель хімії: На нашій планеті є речовина, якій зобов’язане своїм існуванням усе живе. Їй присвячено безліч казок, пісень, віршів…(показ слайдів про воду) Найпоширенішим оксидом є вода (Н2О). Велике значення вода має в житті людини, рослин і тварин. Її широко використовують у побуті та промисловості. Згадаймо фізичні властивості води.
3.3. Прийом «Проблемне питання» Який колір має вода?
Учень – хімік: Ми знаємо, що вода найчастіше відображає колір неба. Залежно від погоди вона може бути від темно-сірої до лагідно-блакитної. Але чому вода насправді має переважно синій колір?
Учень - фізик: Відповідь досить проста. Коли промінь сонця потрапляє на поверхню води, усі кольори його спектру, за виключенням блакитного, швидко поглинаються. Тому ми спостерігаємо відтінки синього кольору, який “затримується” й надає воді такого кольору.
Учитель хімії:? На що впливає підвищення температури води (Відповідь. На зміну агрегатного стану речовини.) В яких агрегатних станах може перебувати вода? (Відповідь. Вода може перебувати у трьох агрегатних станах: твердий, рідкий, газоподібний.)
Учитель хімії: Від чого залежить агрегатний стан речовини?
(Відповідь фізиків. Молекули в речовинах перебувають на певній відстані одна від одної. Цю відстань визначає агрегатний стан речовини.)
3.4. Дослідження четверте. Зазирнемо на кухню. Як людина використовує воду?(5хв.)
Учитель фізики: Чи може вода одночасно бути в одній пробірці у трьох агрегатних станах?(Показує дослід)
Опис досліду: беремо пробірку, наливаємо води і кладемо лід всередину. Нагріваємо верхню частину пробірки , яка закріплена на штативі, вода починає кипіти і випаровуватися, а лід плаває у воді.
Завдання для учнів. Пояснити результат досліду, використовуючи знання про будову речовин.( Відповідь: проміжки між молекулами в рідинах більші, ніж у твердих тілах, а отже, і зіткнення молекул відбувається рідше. Висновок: вода має невелику теплопровідність).
Учитель фізики: Ми бачили, що теплопровідність води невелика. Однак на практиці вода в чайнику досить швидко закипає. Чому нагрівається вода? Як ми нагріваємо чайник? (Відповідь: нагріті шари менш густі і тому легші. Шари більш холодної рідини витісняють їх вгору. Холодні шари опускаються вниз. Через таке перемішування вода рівномірно нагрівається. Відбувається явище конвекції. Чайник нагріваємо завжди знизу.)
Учитель фізики: Які властивості води ми використовуємо для приготування їжі та обігріву класної кімнати взимку?(Відповідь: невелику теплопровідність і процес конвекції.)
Учитель хімії: Давайте разом підіб’ємо підсумки наших досліджень. Які властивості оксидів використовує людина?
1. Висока теплоємність води використовується для опалення приміщень.
2. Властивості гідроген оксиду розчиняти інші речовини використовують для виготовлення різноманітних розчинів у побуті, харчовій промисловості, фармації.
3. Гігроскопічність деяких оксидів забезпечила їм застосування як осушників газів і рідин.
4. Твердість деяких оксидів забезпечила їм застосування як абразивів.
5. Колір деяких металічних елементів у складі оксидів забезпечив застосування оксидів у виготовленні різноманітних фарб.
6. Дезинфікуючі властивості деяких оксидів застосовують для знезаражень приміщень.
V. Рефлексія. Очікування. (3хв.)
Учитель. Дивлячись на нашу гілочку, я можу сказати, що мої та ваші очікування виправдалися. Як ви вважаєте, чи досягли ми мети уроку?
Чи корисні вам будуть ці знання у майбутньому?
(Учні по черзі говорять, про що вони дізналися на уроці, про результат їх кропіткої праці).
- 3.Вправа «Передай далі…»
- що тебе зацікавило? (Те, що до фарб різних кольорів додають оксиди металічних елементів: Zn, Cr, Fe, Co);
- що здивувало? (Те, що весь Карбон, що входить до складу органічних речовин живої та неживої природи, надійшов до них з діоксиду карбону завдяки фотосинтезу у рослинах);
- що схвилювало? (Те, що внаслідок господарської діяльності вуглекислого газу стає все більше в атмосфері, особливо у великих містах);
- що спонукало замислитись? (Те, що наша вода забруднена);
- що найбільше запам’яталось? (Те, що «Джерелом життя на Землі є вода (гідроген оксид), яка найчастіше використовується).
VI.Домашнє завдання: (1хв.) опрацювати відповідний параграф підручника.
Творче завдання: скласти кросворд, ребуси, загадки за темою.
VII. Підсумок уроку(1хв.)
Учитель хімії: Сьогодні на уроці ми з вами розширили свої знання про оксиди, а зокрема, їх поширення та використання; ви з’ясували, що найпоширенішим і найбільш використовуваним є гідроген оксид – вода; як його ще називають «джерело життя». І пам’ятайте: поки є оксиди, є життя на планеті Земля. Посміхніться собі, одне одному, вчителю; якщо ви задоволені собою, підніміть дві руки; якщо задоволені роботою на уроці — лясніть один раз, якщо задоволені роботою класу — лясніть двічі, уроком — тричі.
Учитель. Дякую всім за плідну працю й бажаю успіхів, творчості, гарного настрою.
Список використаних джерел.
1.Дослідна та проектна діяльність під час вивчення хімії [Текст] / укладач К.М. Задорожний. – Х.: Видавнича група «Основа», 2008.– 107 с. – (Бібліотека журналу «Хімія». Вип. 4 (64)).
2. Задорожний К.М. Бінарні уроки та зв’язок із іншими предметами під час викладання хімії [Текст] / К.М. Задорожний. – Х.: Видавнича група «Основа», 2008. – 109 с. – (Бібліотека журналу «Хімія». Вип. 5(65)).
3.Задорожний К.М. Нові педагогічні технології для вчителів хімії [Текст] / К.М. Задорожний. – Х.: Видавнича група «Основа», 2009. – 140 с.– (Бібліотека журналу «Хімія». Вип. 11 (83)).
4. Задорожний К.М. Педагогічна майстерня вчителя хімії. Випуск 3 [Текст] / К.М. Задорожний. – Х.: Видавнича група «Основа», 2010. – 142 с.: табл., іл. – (Бібліотека журналу «Хімія». Вип. 2 (86))
5. Матієк Т.Р. Використання новітніх освітніх технологій навчання на уроках хімії //Хімія.-Квітень 2015.-№7-8.-20с.
6. Пометун О. І, та ін.. Сучасний урок. Інтерактивні технології навчання: Наук. метод. посібн. / О. І. Пометун, Л. В. Пироженко. За ред.. О. І. Пометун. − К. : видавництво А.С.К., 2004. − 192 с.


про публікацію авторської розробки
Додати розробку
