Посібник для учнів за темою «Розрахунки за хімічними рівняннями кількості речовини, маси, об’єму газів реагентів та продуктів реакцій».
| В посібнику вміщені приклади розрахунків за хімічними рівняннями кількості речовини, маси, об'єму газів реагентів та продуктів реакцій та завдання для самостійного розв'язання . |
Обчислення за хімічними рівняннями . Хімія 8 клас.
Хімія 8 клас
Тема Розрахунки за хімічними рівняннями кількості речовини, маси, об’єму газів реагентів та продуктів реакцій.
Навчальний посібник
Учнів 8 класу
…………………………………..…………………..
……………………………………..………………...
2010
Тема Розрахунки за хімічними рівняннями кількості речовини,
маси, об’єму газів реагентів та продуктів реакцій. §23
Теоретична частина.
Реагенти—речовини, які вступають в реакцію (знаходяться в рівнянні зліва від = )
Продукти реакції— речовини, які утворюються в результаті реакції (зправа від = )
Розрахунки речовин ведуться за співвідношеннями коефіцієнтів у рівняннях, які відображають кількість речовини реагентів і продуктів реакції.
1. Завдання: Розгляньте приклад реакції взаємодії гідроксиду калію і сульфатної кислоти у підручнику та з’ясуйте в якій кількості та співвідношеннях реагують і утворюються нові речовини.
Реагуючи речовини Продукти реакції
2KOH + H2SO4 = K2SO4 + 2H2O
2 моль 1 моль 1 моль 2 моль
Коєфіцієнти відображають що вступає і утворюється
кількість речовини,
Співвідношення коефіцієнтів 2 1 1 2
Цими співвідношеннями користуються при розрахунках так як
речовини вступають у хімічні реакції в кількостях,
що пропорційні їхнім коефіцієнтам у рівнянні реакції.
Розрахунки за хімічними рівняннями кількості речовини
Для прикладу візьмемо кількість КОН –– 5 моль.
Яка кількість K2SO4 утвориться в результаті реакції?
![]()
![]() Відомо:
Відомо:
γ(КОН) =5 моль
![]() Знайти:
Знайти:
γ(K2SO4) —х моль
2KOH + H2SO4 = K2SO4 + 2H2O
За рівнянням вступає в реакцію 2 моль 1 моль — утворюється
За умовою задачі 5 моль x моль
Розв’язавши пропорцію 2 1 дізнаємось x 5 · 1 2,5 Утвориться 2,5 моль K2SO4
5 x 2
Відповідь: γ ( K2SO4 ) = 1,5 моль
Практична частина
Завдання: Розв’яжіть аналогічні задачі.
Для того щоб обчислити за рівняннями реакції кількість речовини реагента чи будь якого продукту реакції, достатньо мати відомості про одну з речовин.
1.Задача Яка кількість магній хлориду MgCl2 утвориться при взаємодії 3 моль хлоридної кислоти HCl з магній оксидом MgO?
- Прочитайте умову задачі та визначить, які речовини відомі та які потрібно вирахувати.
|
|
Речовини |
Формула |
Одиниця вимірювання |
Числове значення |
Скорочений запис од. вимір. |
|
Відомі |
Вихідні речовини |
….. |
Кільксть |
………. |
моль |
|
Знайти |
Продукти реакції |
………… |
Кільксть |
X |
моль |
- Запишіть скорочену умову задачі.
- Складіть рівняння реакції та урівняйте його.
-
Складіть кількісні відношення речовин,
зазначених в у рівнянні реакції та в умові задачі. - Розв’яжіть пропорцію та знайдіть шукану кількість речовини.
![]() Відомо: Розв’язування:
Відомо: Розв’язування:
![]() γ (HCl) = …… моль MgO + 2HCl = MgCl2 + H2O
γ (HCl) = …… моль MgO + 2HCl = MgCl2 + H2O
Знайти: За рівнянням— 2 моль 1 моль
γ (MgCl2) —? За умовою задачі— 3 моль х моль
х 3 1 1,5 моль
2 Відповідь: γ (MgCl2) = 1,5 моль
2.Задача Розгляньте послідовність розв’язування прикладу 1 в підручнику.
Розв’яжіть самостійно
3. Задача Яку кількість сульфур(VI)оксиду (н.у) необхідно розчинити у воді для добування сульфатної кислоти кількістю речовини 2,25 моль?
1. Прочитайте умову задачі та визначить, які речовини відомі та які потрібно вирахувати.
|
|
Речовини |
Формула |
Одиниця вимірювання |
Числове значення |
Скорочений запис од. вимір. |
|
Відомі |
Вихідні речовини |
|
Кільксть |
|
моль |
|
Знайти |
Продукти реакції |
|
Кільксть |
|
моль |
2. Запишіть скорочену умову задачі
![]()
![]()
![]() Відомо: Розв’язання
Відомо: Розв’язання
γ (Н2 SO4) = …..моль 3.Складіть рівняння хімічної реакції. Урівняйте.
Знайти: Підкресліть речовини зазначені в задачі
γ (SO 3) — ? ………………………………………………………………….…………………….
За рівнянням —
За умовою задачі —
- Визначіть кількісні відношення речовин, зазначених в у рівнянні реакції та в умові задачі.
5. Розв’яжіть пропорцію та знайдіть шукану кількість речовини.
Розв’язування пропорції: Х= Відповідь: γ(SO3)=
Домашня робота
1.Задача Визначіть яка кількість речовини сульфур(ІІ)оксиду утвориться при взаємодії 5 моль сірководню з киснем. (рівняння реакції: 2H2S +3O2 2SO2 +H2O )
2.Задача Яка кількість речовини кисню необхідна для спалювання сірководню кількістю 1,5 моль? (рівняння реакції аналогічне)
3. Задача Яка кількість речовини фосфор(V)оксиду утвориться при згорянні фосфору кількістю речовини 2 моль?
Розрахунки за хімічними рівняннями маси речовини
4. Задача: Визначити масу натрій гідроксиду, яка утвориться, якщо в надлишку води розчинити натрій оксид кількістю 3 моль.
- Прочитайте умову задачі та визначить, які речовини відомі та які потрібно вирахувати.
|
Величини |
Речовини |
Формула |
Одиниця вимірювання |
Числове значення |
Скорочений запис од. вимір. |
|
Відомі |
Вихідні речовини |
Na2O |
Кільксть |
3 |
моль |
|
Знайти |
Продукти реакції |
NaOH |
маса |
X |
г |
- Запишіть скорочену умову задачі.
![]()
![]() Відомо: Розв’язання
Відомо: Розв’язання
γ (Na2O) = 3 моль 3. Складіть рівняння хімічної реакції. Урівняйте.
m(NaOH) — Х Підкресліть речовини зазначені в задачі
Na2O + H2O = 2NaOH
4. Визначіть кількісні відношення речовин, зазначених в у рівнянні реакції
та в умові задачі.
![]() Na2O + H2O = 2NaOH
Na2O + H2O = 2NaOH
за рівнянням реакції— 1 моль 2 моль
згідно умови задачи — 3 моль Х моль
5. Розв’яжіть пропорцію та знайдіть шукану кількість речовини.
Розв’язування пропорції X = 3 · 2 = 6 моль:
1
6. Вираховуємо за формулою масу речовини згідно умови задачи.
m = γ · M M(NaОН) = 40 г/моль
т (NaОН) = γ(NaОН) · M(NaОН)
т (NaОН) = 6 · 40 = 240г
Відповідь: т (NaОН) = 24г.
Завдання: Розгляньте приклад розв’язуваня задач (Приклад 2 сторінка 107) наведений в підручнику. Запишіть до робочого зошита.
Домашня робота
1.Задача: Яка маса солі кальцій хлориду CaCl2 утвориться при взаємодії кальцій оксиду CaO з хлоридною кислотою HCl кількістю 3 моль?
2. Задача: Яку масу солі калій нітрату KNO3 можна добути при взаємодії калій оксиду K2O і нітратної кислоти HNO3 кількістю 5 моль?
Розрахунки за хімічними рівняннями об’єму речовини
У розрахунках задач використовуються фізичні величини, їх розмірності та взаємозв’язки.
|
Фізична величина |
Позначення |
Розмірність |
Розмірність (кіло) |
|
Кількість речовини |
γ “ню” |
Моль (моль) |
кмоль (кіло моль) |
|
Маса |
m |
Г (грам) |
кг (кілограм) |
|
Молярна маса |
М |
г/моль (грам на моль) |
кг/кмоль |
|
Об’єм |
V |
л (літр) |
М3 /кмоль |
|
Молярний об’єм |
Vm |
22,4 л/моль |
22,4 л/моль |
Формули для підрахування
![]()
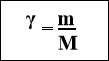
![]()
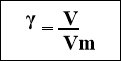
маси кількості об’єму кількості
1.Задача: Розрахувати об’єм водню який утвориться під час взаємодії алюмінію
масою 81 грам із хлоридною кислотою.
- Прочитайте умову задачі та визначить, які речовини відомі та які потрібно вирахувати.
|
величини |
Речовини |
Формула |
Одиниця вимірювання |
Числове значення |
Скорочений запис од. вимір. |
|
Відомі |
Вихідні речовини |
|
|
|
|
|
Знайти |
Продукти реакції |
|
|
|
|
2. Запишіть скорочену умову задачі, визначиться за якими формулами будете вираховувати шукану речовину. Обчисліть молярну масу.
![]() Відомо: Розв’язання
Відомо: Розв’язання
![]()
![]() m(Аl) = 3. Складіть рівняння хімічної реакції. Урівняйте. Знайти: 2Аl + 6HCl = 2AlCl3 +Н2
m(Аl) = 3. Складіть рівняння хімічної реакції. Урівняйте. Знайти: 2Аl + 6HCl = 2AlCl3 +Н2
V(Н2) — Х 4. Переведіть масу речовини Аl у кількість
за формулою γ m γ(Аl) m(Аl) 81 3 моль
М М(Аl) 27
5. Визначіть кількісні відношення речовин, зазначених в у рівнянні реакції
та в умові задачі.
2Аl + 6HCl = 2AlCl3 +Н2
за рівнянням реакції — 2 моль 1 моль
гідно умови задачи — ... моль …. моль
6. Складаємо та розв’язуємо пропорцію X 3 · 1 …… моль
2
- Вираховуємо за формулою об’єм водню згідно умови задачі за формулою:
V= γ · Vm V(Н2) = …….· 22,4 л =
Відповідь: V(Н2) = ……
1


про публікацію авторської розробки
Додати розробку
