Посібник з хімії ВПРАВИ І ЗАДАЧІ З ХІМІЇ – ЦЕ ЦІКАВО!!! 7-9 КЛАС
 Відділ освіти Рокитнівської райдержадміністрації
Відділ освіти Рокитнівської райдержадміністрації
Сновидовицька загальноосвітня школа І-ІІІ ступенів
Рокитнівської районної ради Рівненської області




Рокитне - 2016
Автор-упорядник:
Букеєва Павлина Василівна, вчитель хімії Сновидовицької загальноосвітньої школи І-ІІІ ступенів, кваліфікаційна категорія «спеціаліст»
Вправи і задачі з хімії – це цікаво!!! 7-9 клас. – Рокитне, 2016, - 28 с.
Рецензент:
Романчук Інна Миколаївна, методист районного методичного кабінету Рокитнівської районної ради
Вправи і задачі з хімії відповідають чинній Програмі з хімії 7 – 11 класи для загальноосвітніх навчальних закладів.
Завдання для кожної теми, підібрані так, що їх можна застосувати для самостійної, групової та індивідуальної роботи з учнями. Структура завдань, їх розмаїття дозволить педагогу перетворити заняття на цікаву й плідну співпрацю вчителя і учня.
Також у посібнику після кожної теми розміщені сторінки для допитливих.
Схвалено методичною радою Сновидовицької загальноосвітньої школи І-ІІІ ступенів Рокитнівської районної ради Рівненської області. Протокол №3 від 06 січня 2016 р.
Зміст
Тема 2. Періодична система хімічних елементів Д.І. Менделєєва
Тема 3. Хімічний зв’язок і будова речовини
Тема 4. Основні класи неорганічних сполук
Вступ
Знання робить нас людиною. Тому, найголовнішою цінністю людини в сучасному динамічному суспільстві є знання. І саме вчитель – провідник до вічних цінностей, до знань.
У сучасній педагогічній практиці спостерігається тенденція до пошуку шляхів активізації пізнавальної діяльності учня, що дає змогу відкрити світ як систему систем, як картину суперечностей, озброїти школяра способами розв’язання різноманітних проблемних ситуацій. допомогти йому отримати той рівень знань, який він може і хоче отримати.
Відповідно до нової освітньої концепції, особистість, що навчається, сама будує власний освітній процес, а найважливішою функцією педагога є
стимулювання й підтримка процесу самоосвіти і саморозвитку особистості.
Розвиток науки і техніки дав учителям та учням нові форми комунікації, нові способи вирішення абстрактних та конкретних завдань, перетворюючи вчителя з авторитарного транслятора готових ідей на натхненника у процесі розвитку інтелектуального і творчого потенціалу учнів, їх критичного мислення
Критичне мислення – це складний ментальний процес який починається із залучення інформації і закінчується прийняттям рішення.
В цьому збірнику учням пропонуються різнотипні завдання (класифікувати хімічні об’єкти, вказати сфери їх застосування, виконати обчислення за формулами, розв’язати розрахункову задачу, графічні завдання, скласти рівняння реакцій, малюнки-задачі і т.д.)
- Вони дають змогу на уроках хімії:
-
Розвивати соціальну та громадську компетентності;
Розвивати пізнавальні можливості учнів у здобуванні, аналізі та - застосуванні інформації з різних джерел;
- Використовувати здобуті знання в нестандартних ситуаціях;
- Активно взаємодіяти всередині учнівського колективу;
- Розвивати комунікативні уміння і навички;
- Поєднувати різноманітні види діяльності
- Працювати на уроці в міру своїх можливостей.
Сторінки для допитливих покликані активізувати навчальний процес та розвивати критичне мислення.


Відгадай загадку
Цариця є серед наук,
Що математикою звуть,
Та є не менш важлива;
Що зветься… вона.

Доповни трикутник пізнання
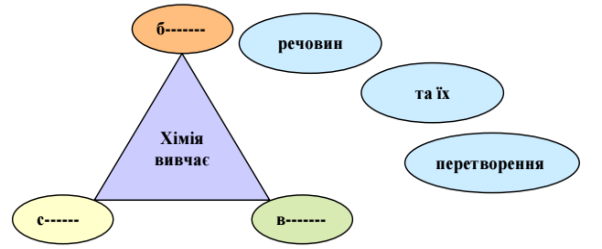

На листочках напиши основні
завдання хімії


Гра “Загадки старого аптекаря”
Дати визначення:
- “хімічний елемент”
- “атом”
- “молекула”
- “відносна атомна маса”
- “хімічна формула”
- “індекс”
- “коефіцієнт”
- “якісний склад”
- “кількісний склад”
- “речовина”
- “неметали”
- “метали”

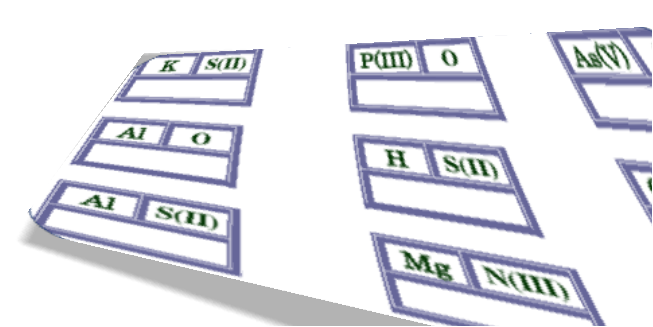
Склади формули сполук


Після догоряння багаття залишається купка попелу
набагато меншої маси, ніж була маса дров. Чи не суперечить це закону збереження маси речовин?


Цікава властивість срібла
IV столітті до нашої ери війська Олександра Македонського вторглися до Індії. На берегах річки Інд у військах вибухнула епідемія шлунково-кишкових захворювань, яка, як не дивно , не торкнулася жодного воєначальника. Виявилося , що прості воїни користувалися олов’яним посудом, а їх командири — срібним. Тоді й згадали, що перський цар Кір II Великий про час військових походів наказував зберігати питну воду в срібних посудинах . Багато пізніше римські легіонери стали носити панцири, наколінники і поножі зі срібла. Срібло має бактерицидні властивості, тому сприяло швидкому загоєнню ран без нагноєнь





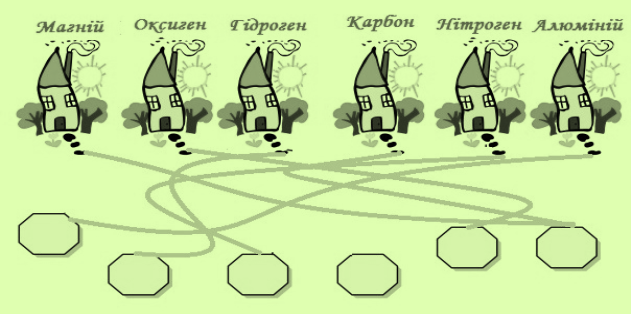
Підпиши листа адресату

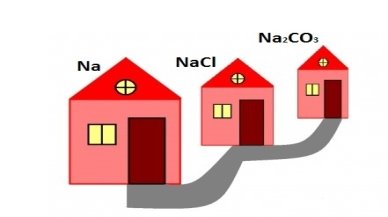
Символами познач «жителів» будиночку

«Цікавий квадрат»
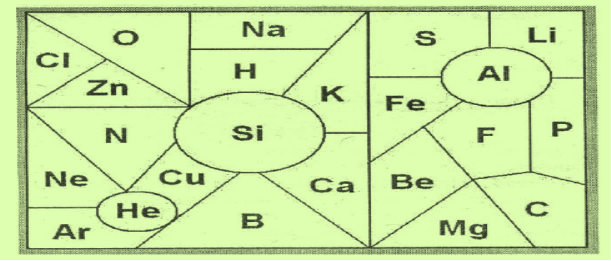
1. З’єднайте стрілочками елементи за порядком, починаючи з Гідрогену.
2. Знайдіть і випишіть усі металічні (неметалічні) елементи, запишіть їх назви.
3. Знайдіть трійки хімічних елементів, сума порядкових номерів яких дорівнює 24 і 36 ?

Казка-загадка

Поблизу великого Бору на Фермій жив кіт на ім'я Лютецій. Яка це була країна — невідомо. Може, Індій чи Германій, а може, Америцій, а то й Францій.
Кіт був не простий, а чарівний. Він був надзвичайно Актиній і рухливий, як Меркурій. Очі кота світилися, як Фосфор, а сам він уночі ставав Неодим. Шубка в нього Сірка з двома біленькими плямами на Талій.
На цій Фермій крім котика Лютеція мешкали ще маленька дівчинка Галій та її мама Іридій.
Лютецій був завжди Радій бачити Галій. Вона часто Берилій котика на руки і бавилася з ним.
Котик інколи захоплював мишку у Полоній, і то був великий Цирконій, коли мишка тікала з Полоній і Молібден бога за свій порятунок.
Наближався день народження Галій, і вона Гадоліній про свої подарунки.
Приїхали гості з Європій, Америцій, Рутеній: Ванадій та Арсен із Тулій, Родій з Каліфорній, Нікол із Самарій.
А найкращим подарунком виявився маленький песик Кобальт. На шиї в нього виблискував сріблястий Силіцій.
Мама Іридій діставала з Барію гостинці й частувала гостей.
Свято було веселим та радісним і тривало, аж поки Гелій сіло за обрій, а на небі з'явився Селен. Між Лютецієм і Кобальтом ледве не дійшло до невеличкого Скандію. Але котик був у стосунках великий Технецій і залагодив їх, Ніобій нічого й не сталося. І собачка завжди зустрічав котика веселим — Гафній, Гафній!
Завдання. Правильно назвіть хімічні елементи, які зустрічаються в тексті.

Дайте відповіді на питання і визначте ключове слово:
1. Найлегший хімічний елемент
2. Крилатий елемент.
3. Елемент, що утворює просту речовину, яка підтримує дихання та горіння.
4. Елемент - символ заможності.
5. Метал війни.
6. Елемент, названий у честь Європейської країни.
7. Метал, який є матеріалом, з якого виготовлений солдатик у одній із казок Г.Х. Андерсена.



Історія «сну Менделєєва»
Свої міркування про періодичній системі елементів Д.І. Менделєєв довго не міг уявити у вигляді ясного узагальнення, суворої і наочної системи. Про завершальній творчий процес інтуїції Менделєєва професор А.А. Іноземців повідомив наступне. Одного разу, вже будучи секретарем фізико-математичного факультету, Іноземців зайшов провідати Менделєєва. Д.І. Менделєєв заговорив про те, що згодом втілилося в періодичну систему елементів, але в ту хвилину закон і таблиця ще не були сформовані. «Все в голові склалося, – з гіркотою додав Менделєєв, – а виразити таблицею не можу». Після цього Менделєєв три дні і три ночі, не лягаючи спати, пропрацював у конторки, пробуючи скомбінувати результати своєї уявної конструкції в таблицю, але спроби виявилися невдалими. Нарешті, вкрай стомлений Менделєєв ліг спати і негайно заснув. Пізніше він говорив: «Бачу у сні таблицю, де елементи розставлені, як потрібно. Прокинувся, негайно записав на клаптику паперу, – тільки в одному місці згодом виявилася потрібною поправка ». Ця розповідь породив різні міфи і спрощені уявлення.


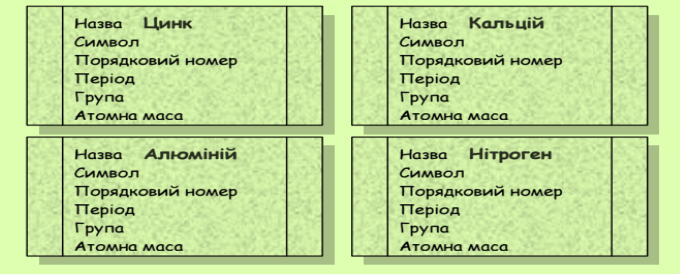
Заповніть таблицю:

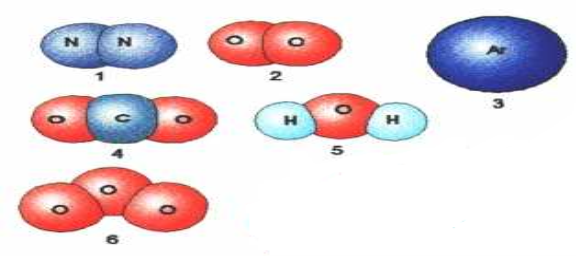
Моделі яких речовин зображені на малюнку? Який тип зв’язку в їхніх молекулах

Вкажіть речовину що має молекулярну кристалічну гратку:
1.Йод 2. Кухонна сіль


3. Графіт 4.Цукор



Відгадайте ребус
|
1.
|
2.
|
|
3. |
4. |

Гра «Хрестики-нулики»
Виберіть ряд, в якому містяться речовини з ковалентним полярним зв’язком
|
Н2 |
НСІ |
І2 |
|
НF |
H2O |
NH3 |
|
O2 |
H2SO4 |
Al |


Найміцніший мінерал
Алмаз - камінь з незвичайним блиском, грою кольорів, внутрішнім вогнем. Блиск у алмазу сильний - алмазний. Алмаз дуже твердий - «цар усіх мінералів». По твердості він не поступається жодному з відомих мінералів. Алмаз є «чемпіоном твердості»: він у 1000 разів твердіше кварцу, в 150 разів твердіше корунду. Може бути, тому стародавні греки вважали алмаз талісманом влади.
Алмаз стійкий до кислот, нагрівання. Це єдиний мінерал, який залишає подряпину на корунді. За цією ознакою відрізняється від схожих з ним мінералів - гірського кришталю, топазу і ін.
Алмаз дуже твердий, але в той же час крихкий. Він легко розколюється по площинах спайності. Спайність досконала по гранях октаедра. Цю властивість алмазу використовують ювеліри при його обробці. Знайдений новий мінерал, що володіє великою твердістю, «брат» алмазу - Якутія.
Жоден дорогоцінний камінь не має стільки відтінків, як алмаз: починаючи від безбарвного до майже чорного, білий, блакитний, зелений, жовтуватий, рожевий, червонуватий, коричневий, димчасто-сірий тони; нерідко прозорий.
Зустрічається алмаз здебільшого у вигляді окремих кристалів - октаедрів з викривленими гранями, за зовнішньою формою наближаються до кулі. Розміри кристалу зазвичай невеликі. Кристалізується в кубічній сингонії.




Засели будинок хімічними сполуками, розміщуючи їх за класами
|
Оксиди |
|
|
Кислоти |
|
|
Основи |
|
|
Солі |
|

Na2O, Ca(OH)2, MgSO4, Al2O3,
HCl, ZnO, H3PO4, NaNO3, KI,
H2S, Ba(OH)2, NaCl, Fe(OH)3,
CO2, HNO3, H2O, Cu(OH)2, KBr.

Здійсни перетворення відповідно до схеми
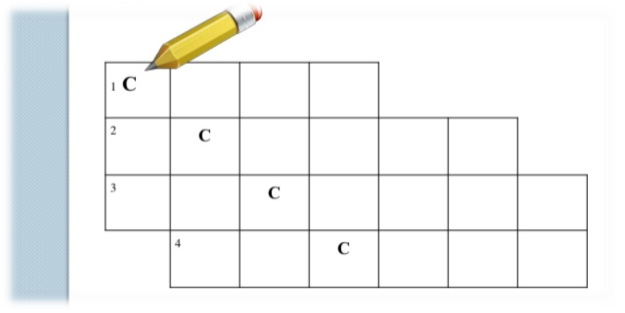
 «С» по діагоналі
«С» по діагоналі
Завдання: у відповідні клітинки впишіть назви класів складних речовин, щоб по діагоналі сходитись літери «С»

Гра «Хімічний морський бій»
Потрібно вразити кислоти
|
|
А |
Б |
В |
Г |
Д |
Е |
Є |
|
1 |
HBr |
KI |
NaCl |
FeO |
Ca |
H2 |
CO2 |
|
2 |
H2O |
HCl |
H2 SO4 |
Na |
Cl2 |
HNO3 |
Zn |
|
3 |
CO |
NH3 |
NaOH |
CaCO3 |
HI |
CH4 |
H3 PO4 |
|
4 |
F2 |
CuSO4 |
Ca(OH)2 |
ZnO |
H2 CO3 |
Fe(OH)3 |
K2SO3 |
|
5 |
Fe(OH)2 |
H2 SO3 |
SO3 |
Br2 |
Fe2(SO4)3 |
P2O5 |
HF |

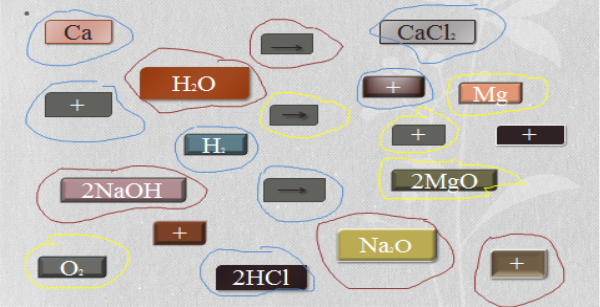
Складіть схеми реакцій


Склади формули
по назві



Чому водоспад у Антарктиді червоний?
 В Антарктиді з льодовика Тейлора часом виходить Кривавий водоспад. Вода в ньому містить двовалентне залізо, яке, з'єднуючись з атмосферним повітрям, окислюється і утворює іржу. Це і додає водоспаду криваво-рудий колір. Однак двовалентне залізо у воді виникає не просто так - його виробляють бактерії, що живуть в ізольованій від зовнішнього світу водоймі глибоко під льодом. Ці бактерії зуміли організувати життєвий цикл при повній відсутності сонячного світла і кисню. Вони переробляють залишки органіки, а «дихають» тривалентним залізом з навколишніх порід.
В Антарктиді з льодовика Тейлора часом виходить Кривавий водоспад. Вода в ньому містить двовалентне залізо, яке, з'єднуючись з атмосферним повітрям, окислюється і утворює іржу. Це і додає водоспаду криваво-рудий колір. Однак двовалентне залізо у воді виникає не просто так - його виробляють бактерії, що живуть в ізольованій від зовнішнього світу водоймі глибоко під льодом. Ці бактерії зуміли організувати життєвий цикл при повній відсутності сонячного світла і кисню. Вони переробляють залишки органіки, а «дихають» тривалентним залізом з навколишніх порід.


Вправа «Ромашка». Відривай пелюсточку і відповідай.




Гра «Третій зайвий» Вибери і поясни.
1) СН4, С2Н4, С2Н6.
2) СН3ОН, С2Н5ОН, С5Н12.
3) С3Н6, С5Н10, С5Н12.

Заповни пропуски в гомологічному ряді алканів
|
СН4 |
С2Н6 |
|
С4Н10, |
|
С5Н12 |
|
С7Н16 |
|
|
|
С10 Н22 |
|
|



Встав невідомі речовини і розтав коефіцієнти


Вправа «Коректор»
Знайди і виправ помилки
1) Крохмаль – це суміш трьох речовин.
2) Крохмаль – це білий аморфний порошок, добре розчинний у воді.
3) Якщо до охолодженого крохмального клейстеру додати розчин іоду, то з̉ являється жовте забарвлення.
4) (С6Н10О5) – структурна формула крохмалю.
 5) Крохмаль – це природний полімер, що складається з багаторазово повторюваних структурних ланок С6Н12О6.
5) Крохмаль – це природний полімер, що складається з багаторазово повторюваних структурних ланок С6Н12О6.

Вправа «Незакінчене речення»
1) Глюкоза являє собою…
2) Глюкоза поширюється в природі…
3) Глюкоза має хімічні властивості характерні для…
4) У молекулі глюкози міститься альдегідна група,тому для глюкози характерна…
5) Глюкоза реагує з купрум(ІІ)гідроксидом, утворюючи комплексну сполуку, забарвлену в…
6) Глюкоза належить до…
7) Широко застосовують глюкозу в… .


Цікаво про алкани
- До складу феромонів тварин входять деякі вищі алкани. Запах феромонів приваблює комах або їх відлякує. Наприклад, феромон тривоги в мурашок-древоточців містить насичений вуглеводень декан. Вуглеводи С16-С36, які є в поверхневому шарі кутикул рослин, запобігають їхньому висиханню. У ході еволюції насичені вуглеводні, які виробляють квітки орхідеї роду Оphrys (О. sphegodes), набули нової функції - приваблювання комах.
- На поверхні фруктів воскоподібна плівка містить гомологи метану.
- Парафін ( С18 – С35) – використовується в медицині (парафінотерапія)
- Вазелінова олія (до С25) - у медицині, парфумерії, косметології
- Вазелін (до С25) - у медицині для виготовлення мазей
- Спрей-заморозку «Doc Spоrt» використовують для швидкого охолодження шкіри і м’язів при вивихах і розтягненнях. Містить зріджені пропан і бутан (раніше С2Н5Сl – токсичний)
- Спрей «Дин фріз» - зовнішній засіб для лікування болю в м’язах, попереку, ревматичного болю, болю від забиття, судом, розтягнення зв’язок. Головна його складова – С5Н12 (на шкірі випаровується, поглинаючи тепло, охолоджує ділянку шкіри.)

![]()


про публікацію авторської розробки
Додати розробку






