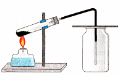
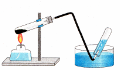
Практична робота № 4 «Добування кисню з гідроген пероксиду, збирання, доведення його наявності» (урок)
Тема: Практична робота № 4 «Добування кисню з гідроген пероксиду, збирання, доведення його наявності»
Мета: ознайомити з лабораторним способом добування кисню, виробляти навички розпізнавання кисню, збирання його; розвивати логічне мислення, пізнавальний інтерес, продовжити формувати навички роботи з лабораторним обладнанням і хімічними реактивами, дотримуватись правил техніки безпеки; виховувати бережливе ставлення до обладнання, реактивів та власного здоров’я.
Обладнання та реактиви: лабораторний штатив із тримачем, нагрівний прилад з відкритим полум’ям, штатив із пробірками, суха пробірка з газовідвідними трубками, хімічна склянка для збирання кисню, скляна пластинка, 30% -й розчин гідроген пероксиду (пергідроль), деревна вуглинка (розміром з горошину), вапняна вода; речовина, що прискорює розкладання пероксиду; пісок
Тип уроку: урок комплексного застосування знань, практична робота
Хід уроку
І. Організаційний момент
1. Повторення правил техніки безпеки Пергідроль (30%-й розчин гідроген пероксиду) — їдка речовина! У разі потрапляння на шкіру може призвести до слабких опіків. Знебарвлює одяг. У разі потрапляння пергідролю на шкіру або одяг його необхідно змити проточною водою. Якщо цього не зробити вчасно, можливе утворення опіку, при цьому відбувається пощипування шкіри та забарвлення її в білий колір. Не лякайтеся: неприємні відчуття швидко минуть, а біла пляма зникне через 2-3 години. Побіління одягу в разі дії пергідролю усунути неможливо — барвник руйнується назавжди.

• Гідроген пероксид у побуті називають перекис водню. Зазвичай він використовується у вигляді 3-5%-го водного розчину для дезінфекції подряпин і дрібних ран. Потрапивши на ранку, гідроген пероксид під дією каталізаторів, наявних у крові, починає виділяти кисень, який убиває бактерії, закупорює дрібні судини і зупиняє кровотечу. Також гідроген пероксид використовують у вигляді 30%-го водного розчину під назвою пергідроль.
• Калій перманганат КМnO4 дуже часто застосовується у побуті та медицині під назвою «марганцівка». Його використовують у вигляді дуже розбавленого розчину для промивання шлунка в разі отруєння.
2. Інструктаж з проведення практичної роботи
Розповідь учителя
Учитель пояснює принципи оформлення результатів практичної роботи в зошитах.
Учитель розповідає про порядок проведення практичної роботи.
( Робота виконується згідно інструкції в зошиті для лабораторних дослідів та практичних робіт).
ІІ. Проведення практичної роботи
- Інструктаж з БЖД

![]()
- Виконання роботи
Добування кисню з гідроген пероксиду, збирання, доведення його наявності
|
Хід експерименту |
Спостереження(рівняння реакції) |
|
1. Добування кисню розкладом гідроген пероксиду У велику пробірку (або плоскодонну колбу) внесіть дрібку каталізатора — манган(ІV) оксиду. Пробірку закрийте корком з двома отворами. В один отвір необхідно вставити газовідвідну трубку, а в інший — піпетку з розчином гідроген пероксиду. Піпеткою краплями додавайте гідроген пероксид і спостерігайте виділення кисню. |
Що спостерігали в пробірці(колбі)? _____________________________________ _____________________________________
Запишіть рівняння реакції: _____________________________________ _____________________________________ _____________________________________ _____________________________________
|
|
2. Збирання кисню методом витіснення повітря
|
Що спостерігали в пробірці? _____________________________________ _____________________________________ |
|
3.Збирання кисню методом витіснення води
|
Що спостерігали в пробірці? _____________________________________ _____________________________________ |
|
4. Доведення наявності кисню Підготуйте тліючу скіпку: спочатку запаліть, а потім загасіть її. Доки скіпка тліє, внесіть її в пробірку із зібраним киснем у досліді 2. Опишіть свої спостереження, складіть рівняння реакцій горіння вугілля (тліючої скіпки). Замалюйте ваш прилад для добування кисню. |
Що спостерігали в пробірці з досліду №2? _____________________________________ _____________________________________
Що спостерігали в пробірці з досліду №3? _____________________________________ _____________________________________
Запишіть рівняння реакції: _____________________________________ _____________________________________
Замалюйте прилад для добування кисню
|
Висновок Кисень можна добути шляхом розкладу ________ під дією ________________, який є ____________________________________.
Довести наявність кисню можна за допомогою _________________________, вона .
Загальний висновок: відповісти на питання
1. Як добувають кисень?
2. Як збирають кисень?
3. Як довести наявність кисню?
4. Які властивості характерні для кисню?
III. Підбиття підсумків уроку
Дайте відповідь на запитання:
1. Як називають метод збирання газів, що ви використали в даній роботі?
2. У який спосіб можна довести, що пробірка повністю заповнена киснем?
3. Чому для добування кисню розкладом гідроген пероксиду краще використовувати колбу, а не пробірку? Яку роль виконує манган(ІV) оксид у цьому методі?
4. Чи можна добути кисень розкладом гідроген пероксиду без манган(ІV) оксиду?
IV. Домашнє завдання
- Повторити вивчений матеріал.
- Досліджуємо вдома разом з батьками! Спостереження записати до зошитів.
Дія гідроген пероксиду на сирі та відварені овочі, м’ясо.
|
Що робили |
Спостереження |
|
Завдання 1. Одночасно нанесли по кілька крапель гідроген пероксиду на свіжі зрізи сирих та варених овочів: картоплі, моркви, буряка. |
На поверхні сирих овочів виділяються бульбашки газу, тому що під дією каталізаторів відбувається розклад гідроген пероксиду: 2Н2О2 = 2Н2О + 2О2 |
|
Завдання 2. Одночасно нанесли по кілька крапель гідроген пероксиду на шматочок сирого (яке не було заморожене) та шматочок відвареного м’яса. |
На шматочку сирого м’яса виділяються бульбашки газу, тому що під дією каталізаторів-ферментів відбувається розклад гідроген пероксиду: 2Н2О2 = 2Н2О + 2О2; На шматочку відвареного м’яса не виділяються бульбашки газу, тому що під дією температури при варенні м’яса відбулося порушення структури каталізаторів-ферментів і розклад гідроген пероксиду не відбувся. |


про публікацію авторської розробки
Додати розробку