Презентація Алюміній,Ферум
Про матеріал
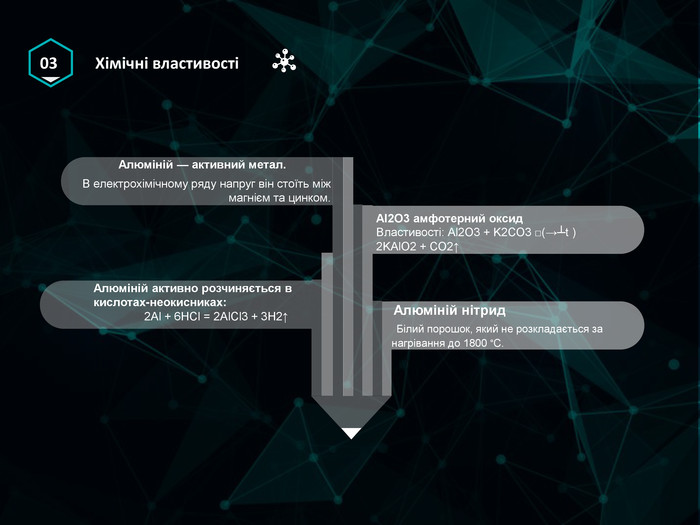
Презентація 11 клас "Алюміній.Ферум" Єлектронна будова,фізичні та хімічні властивості. Знаходження в природі. Застосування Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку