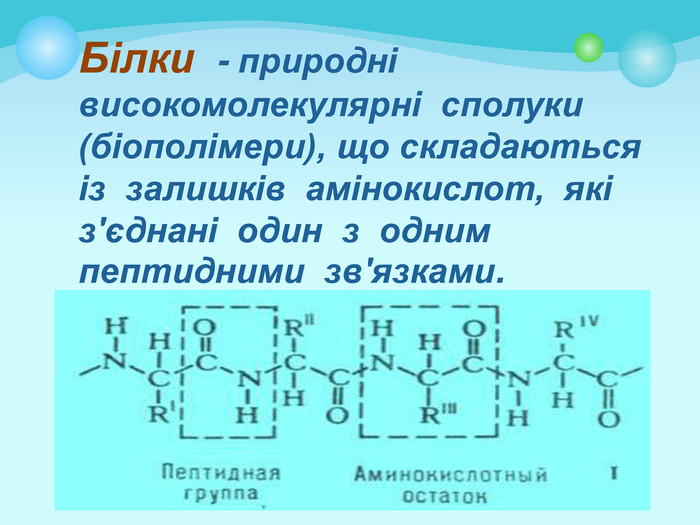
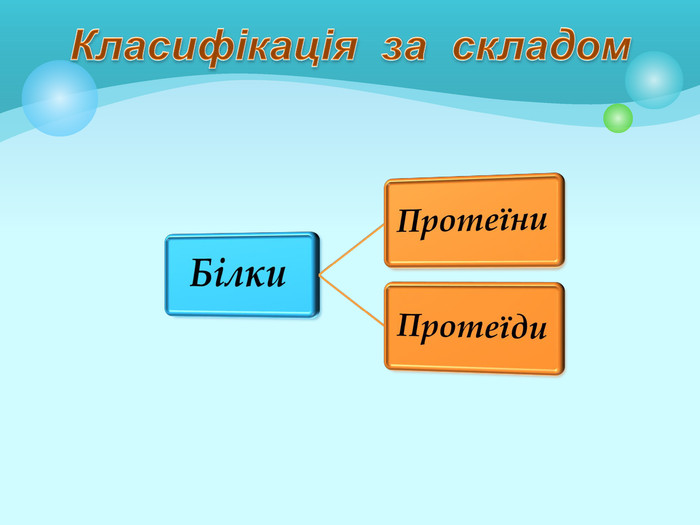
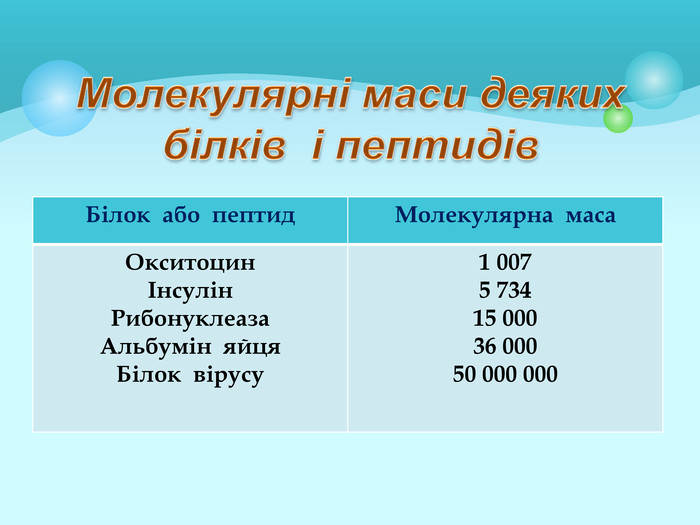
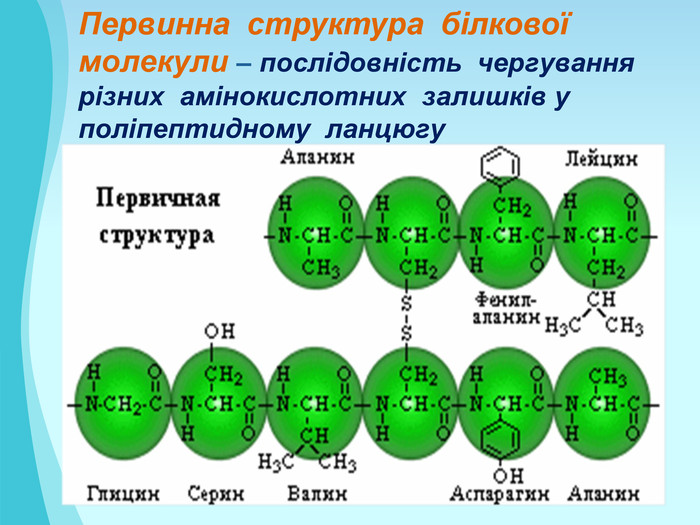
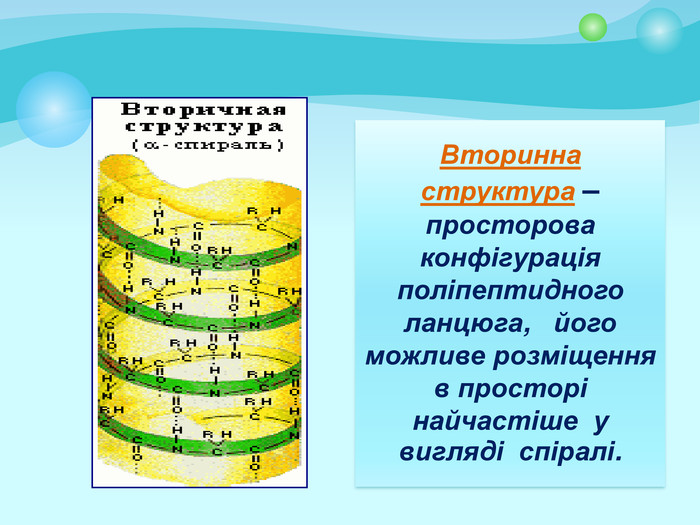
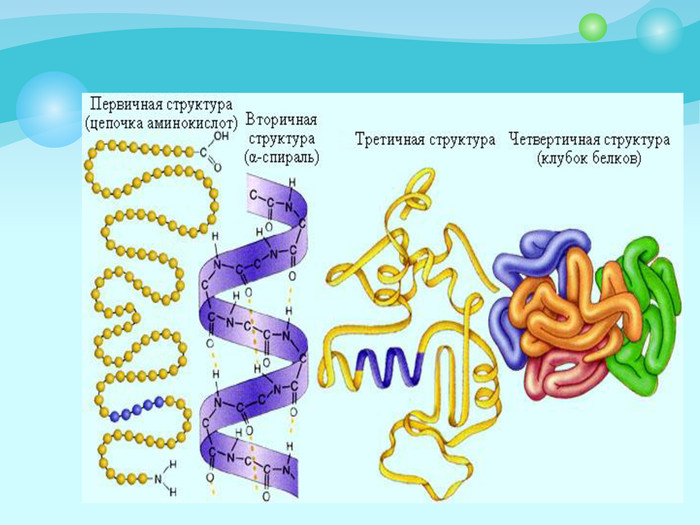
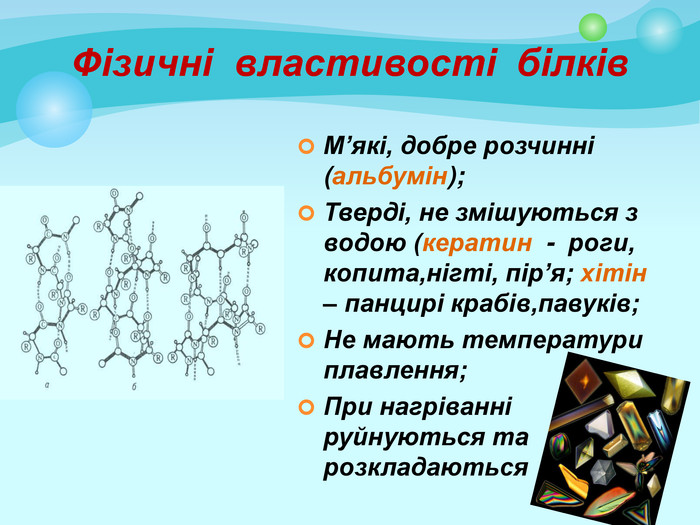
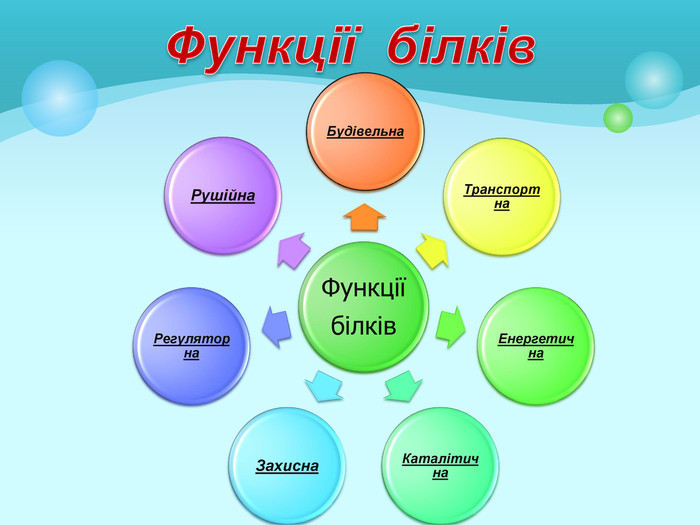
Презентація "Білки: склад, будова і властивості. Біологічна роль білків".
Про матеріал
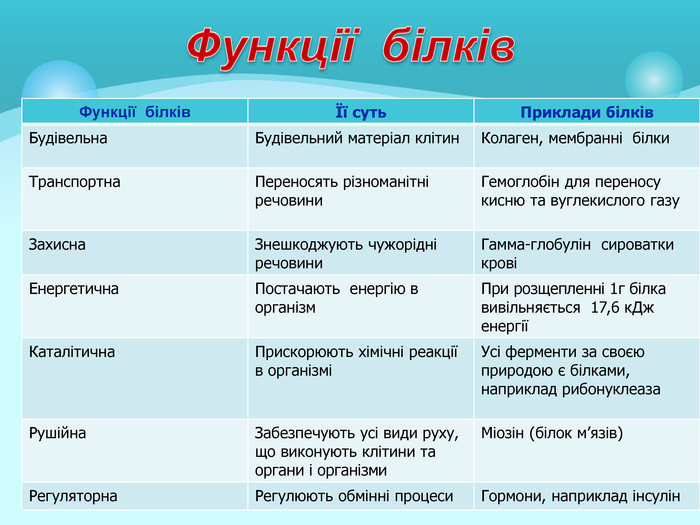
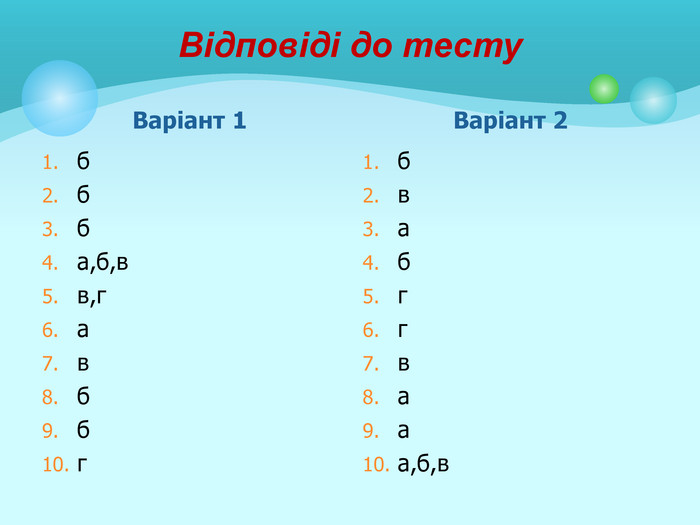
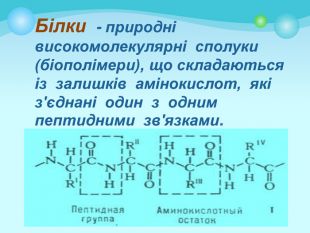
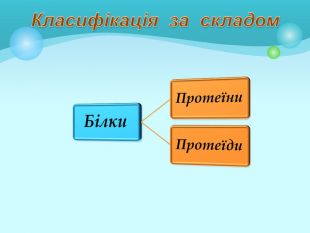
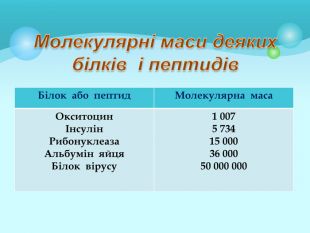
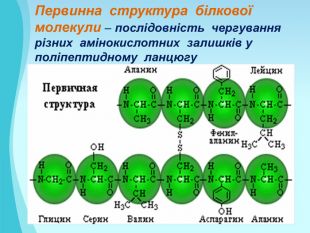
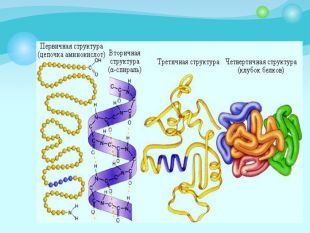
Білки: склад, будова і властивості. Біологічна роль білків. Презентація до уроку з хімії у 9 класі. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Пані Міхаєла,дякую за інформативну презентацію!
-


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку