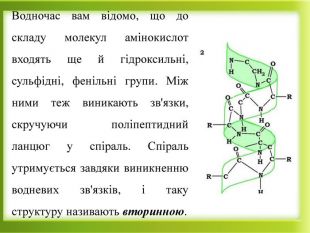
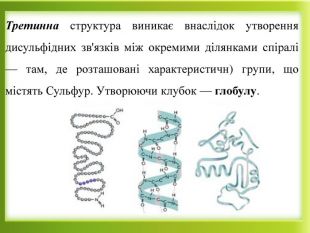
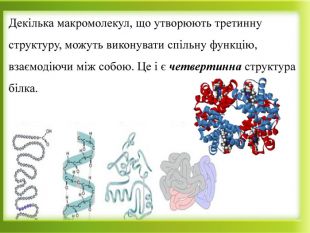
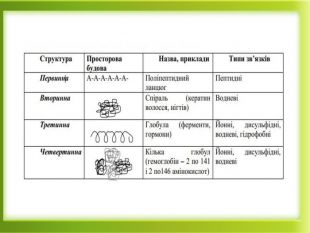
Презентація "Білки як високомолекулярні сполуки. Хімічні властивості білків"
Про матеріал
Презентація "Білки як високомолекулярні сполуки. Хімічні властивості білків" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


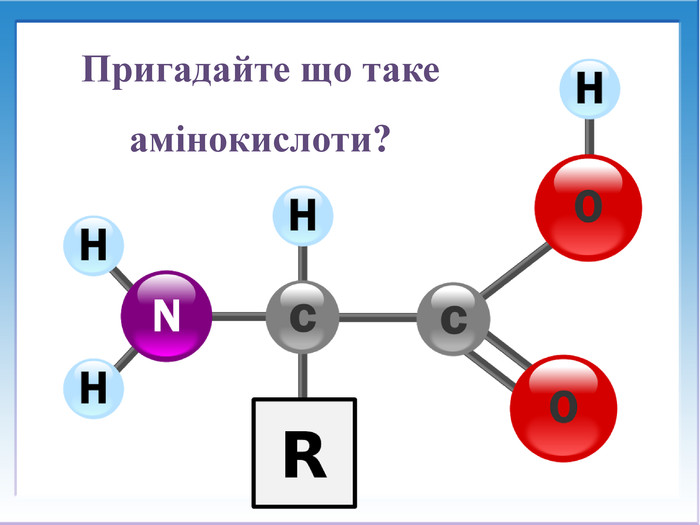
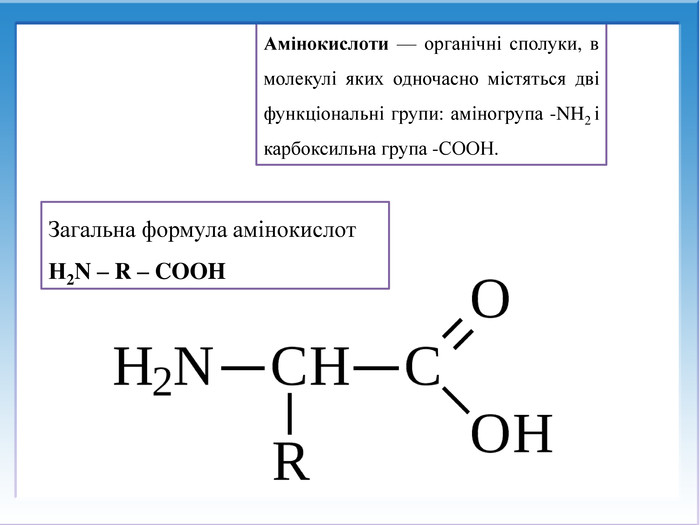



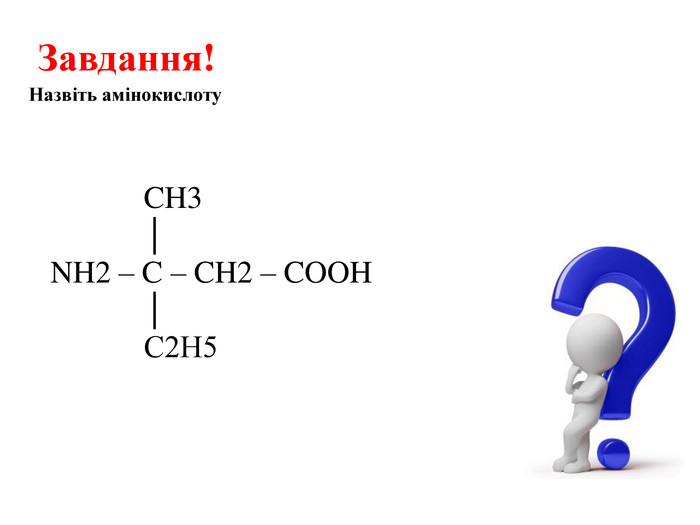





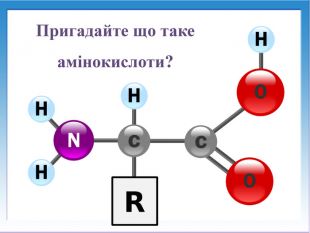
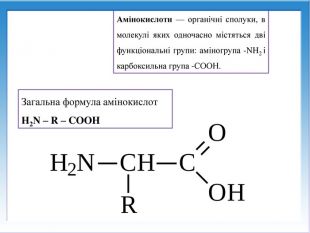
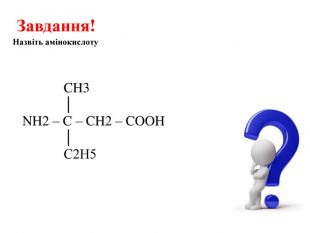
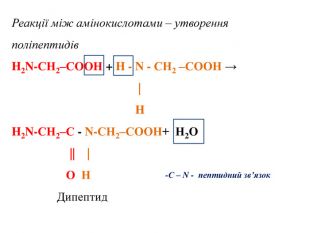
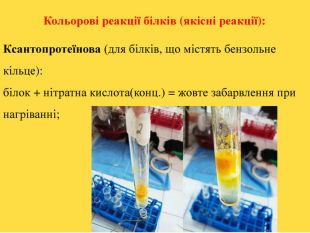
![Реакції за участю аміногрупи – основні властивостіПодібно до амінів (основ), амінокислоти реагують з кислотами: H2 N - СН2 – СООН + НCl → [H3 N - СН2 – СООН]Cl Реакції за участю аміногрупи – основні властивостіПодібно до амінів (основ), амінокислоти реагують з кислотами: H2 N - СН2 – СООН + НCl → [H3 N - СН2 – СООН]Cl](/uploads/files/1008365/247841/267251_images/13.jpg)