Презентація "Будова атома"
Про матеріал
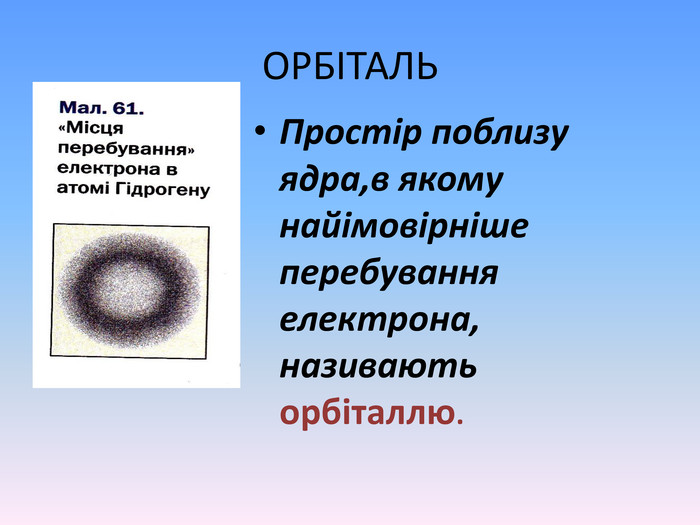
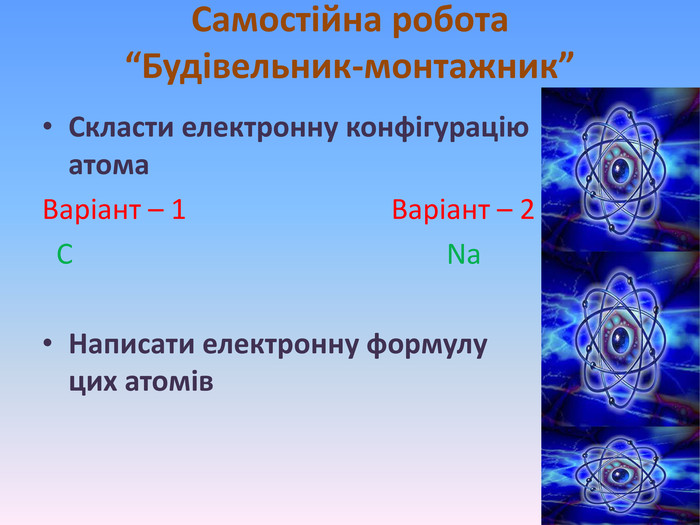
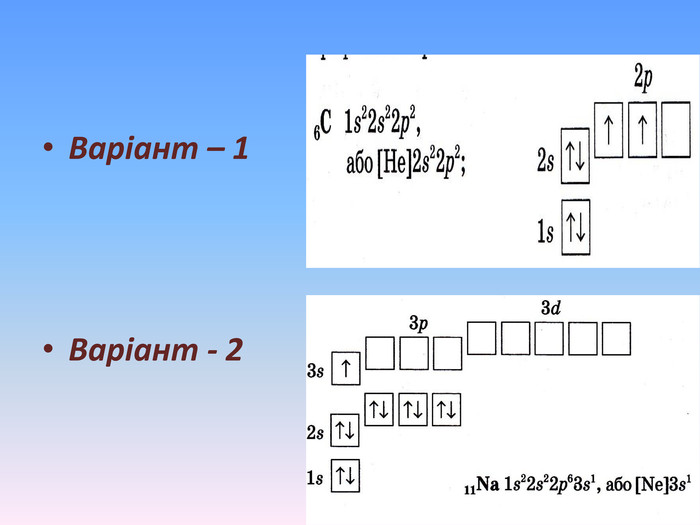
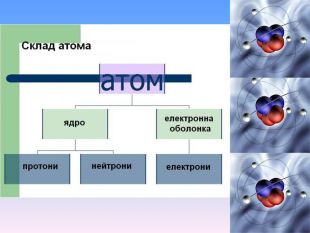
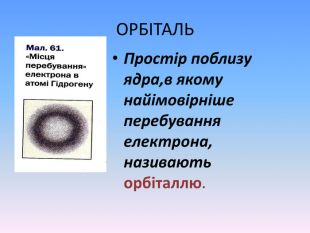
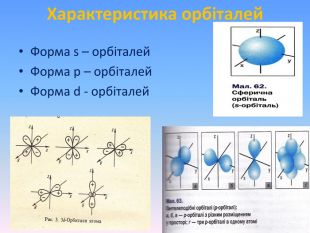
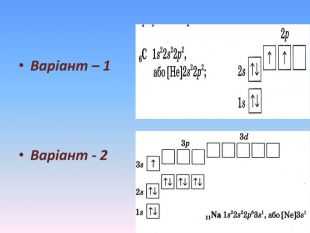
Презентація "Будова атома" - це додатковий матеріал, що дає можливість наглядно та докладно пояснити про стан електронів у атомі та проенергетичні рівні та підрівні. А також надані практичні рекомендації про складання електронно-графічної конфігураціїї атома. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку