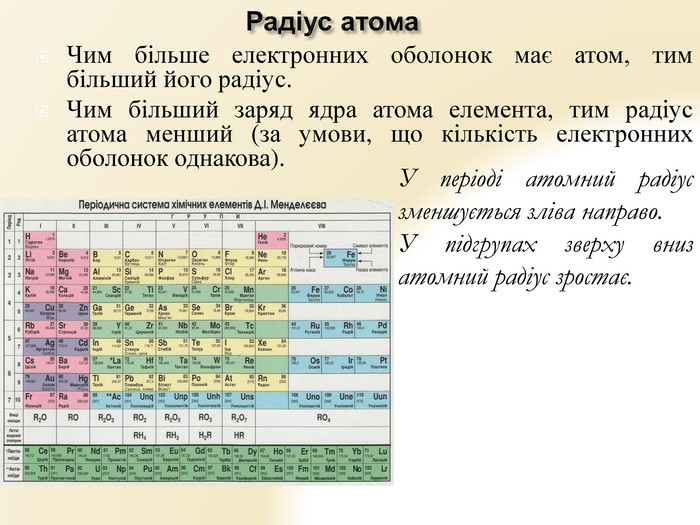
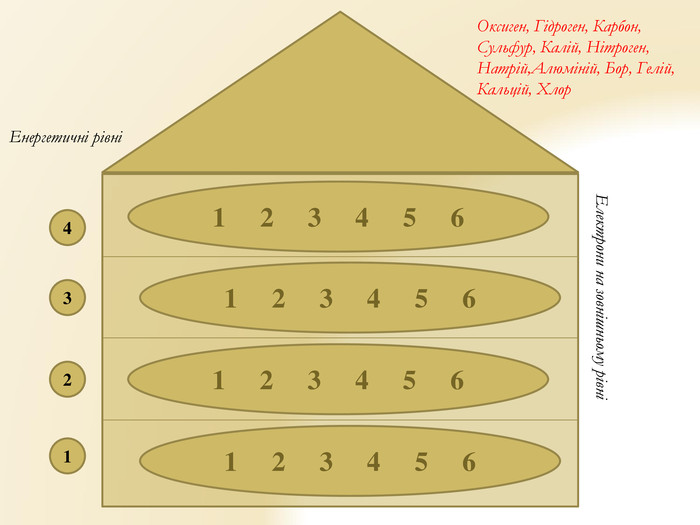
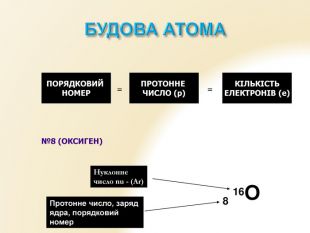
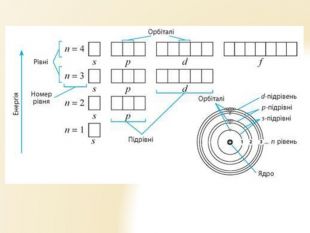
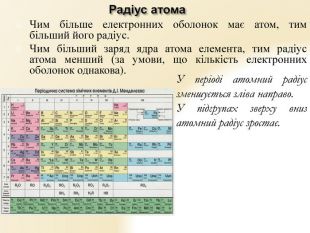
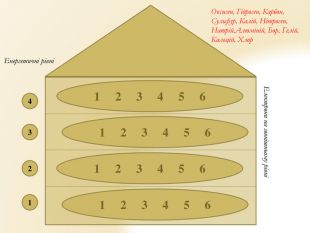
Презентація "Будова атома"
Про матеріал
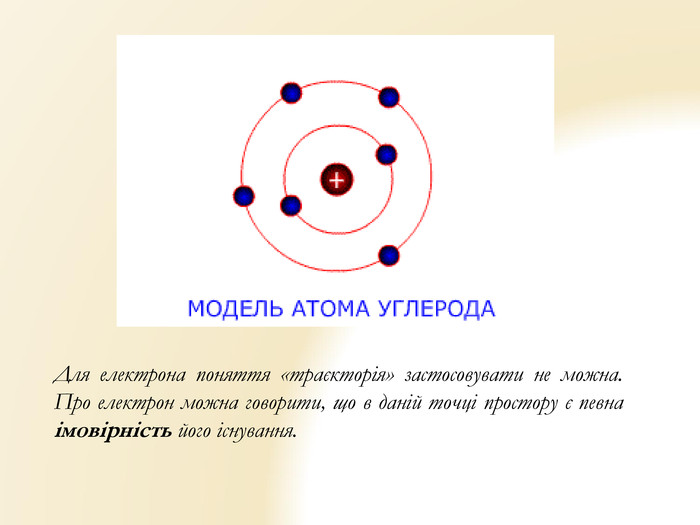
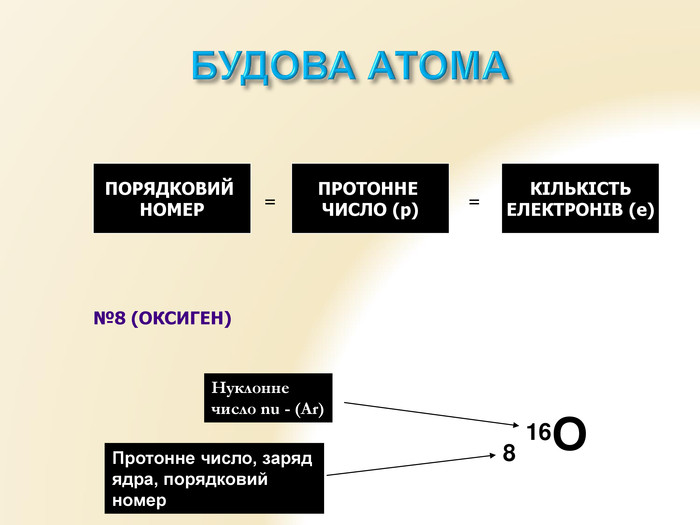
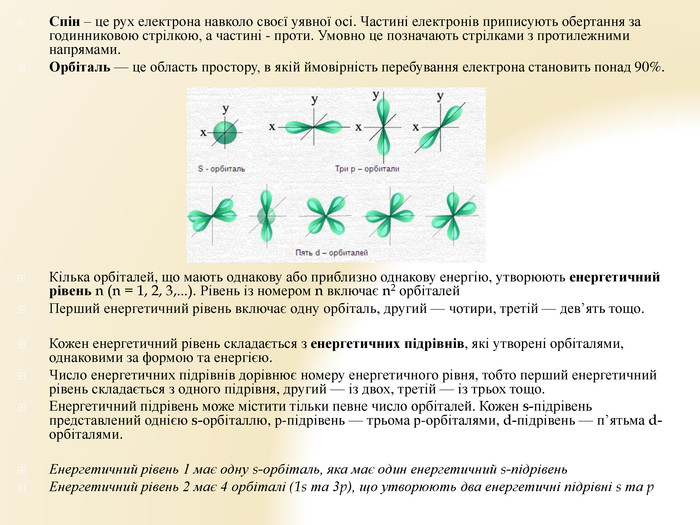
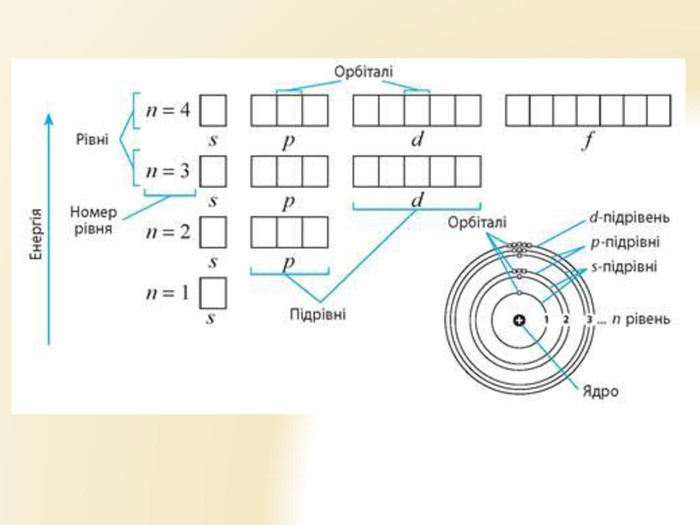
Презентація "Будова атома" для уроків хімії 9 класу. Яскрава наочна презентація, містить вправи Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку