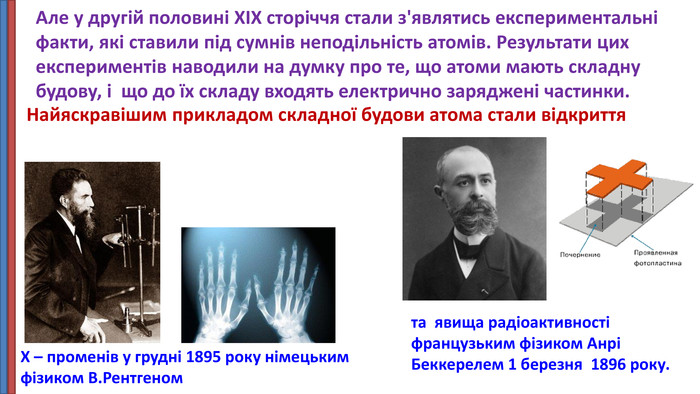
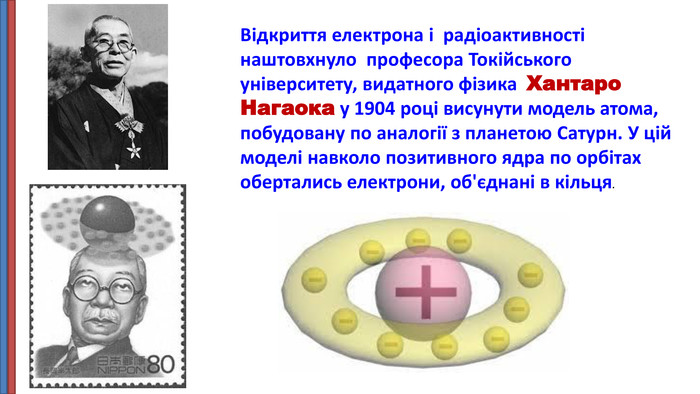
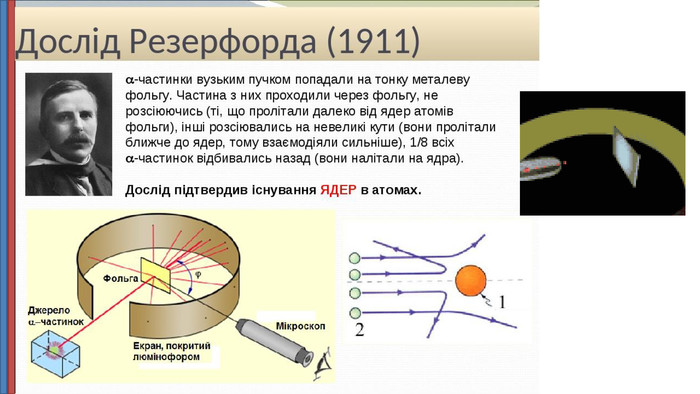
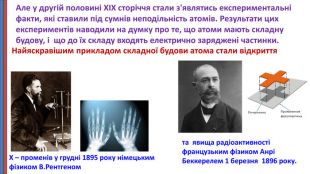
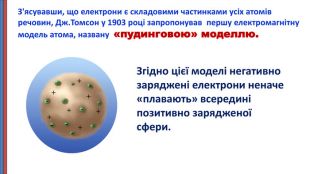
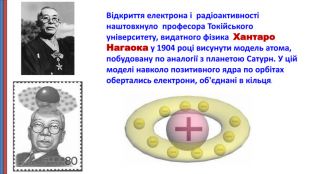
Презентація "Будова атома"
Про матеріал
Матеріал стане в нагоді при поясненні теми в 11 класі, або в 9 класі (окремі слайди) Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку