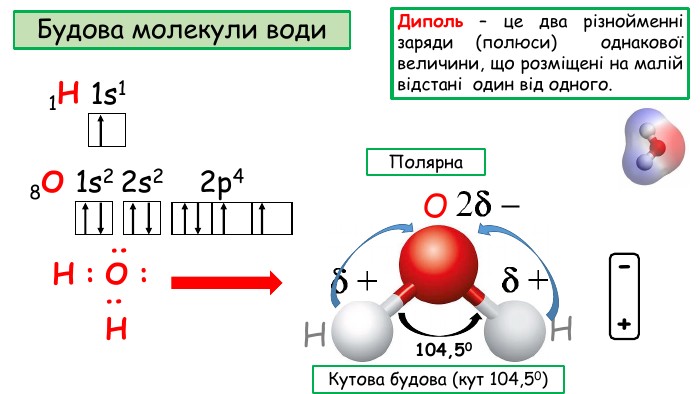
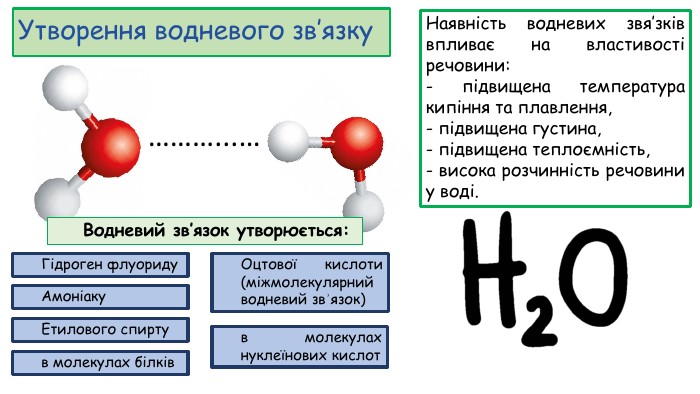
Презентація "Будова молекули води, поняття про водневий зв’язок".
Про матеріал
Презентація до уроку "Будова молекули води, поняття про водневий зв'язок"
Відео-урок за посиланням https://www.youtube.com/watch?v=S7aqq9L1A8s
Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія 9 клас (Березан О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку