Презентация "Діаграма Fe-C"

























![Фазы в сплавах Fe-C (однородная часть системы, отделенная от других частей системы поверхностью раздела, при переходе через которую структура и свойства резко меняются. Фазами могут быть отдельные металлы, их химические соединения, а также твердые и жидкие растворы на основе металлов) жидкий раствор –[Ж] феррит – [Ф] аустенит – [А] цементит – [Ц] свободный углерод в виде графита – [Гр] Фазы в сплавах Fe-C (однородная часть системы, отделенная от других частей системы поверхностью раздела, при переходе через которую структура и свойства резко меняются. Фазами могут быть отдельные металлы, их химические соединения, а также твердые и жидкие растворы на основе металлов) жидкий раствор –[Ж] феррит – [Ф] аустенит – [А] цементит – [Ц] свободный углерод в виде графита – [Гр]](/uploads/files/959083/165760/178396_images/35.jpg)

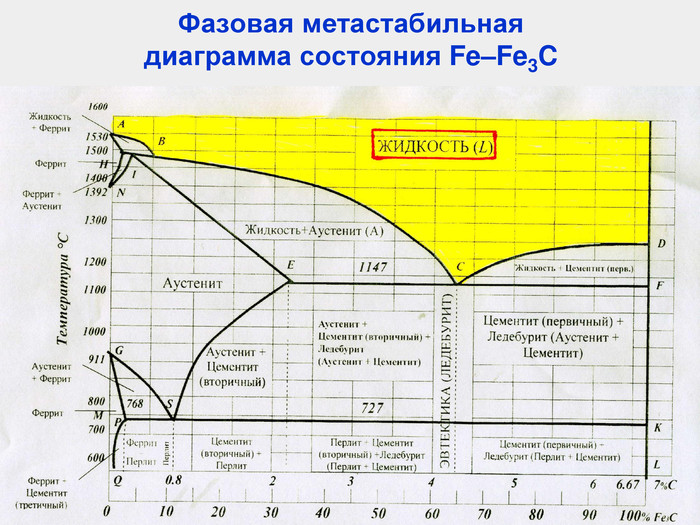




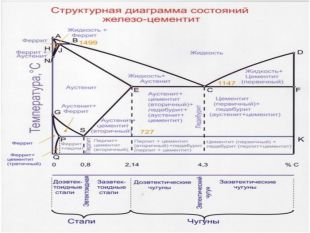
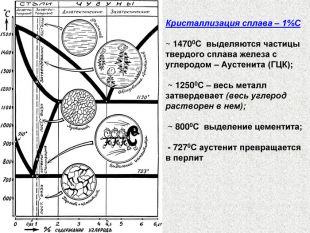
![Характерные линии диаграммы состояния Fe-Fe3C ABCD - начала кристаллизации сплава (ликвидус) AHJECF - конца кристаллизации сплава (солидус) Закристаллизовавшиеся сплавы состоят из трех фаз в разном их сочетании: [A], [Ф], [Ц] В системе Fe-Fe3C происходят три изотермических превращения: HJB – перитектическое (14990С) Фн +Жв Aj ECF – эвтектическое (11470С) Жс АЕ + Ц PSK – эвтектоидное (7270С) АS Фр + Ц Характерные линии диаграммы состояния Fe-Fe3C ABCD - начала кристаллизации сплава (ликвидус) AHJECF - конца кристаллизации сплава (солидус) Закристаллизовавшиеся сплавы состоят из трех фаз в разном их сочетании: [A], [Ф], [Ц] В системе Fe-Fe3C происходят три изотермических превращения: HJB – перитектическое (14990С) Фн +Жв Aj ECF – эвтектическое (11470С) Жс АЕ + Ц PSK – эвтектоидное (7270С) АS Фр + Ц](/uploads/files/959083/165760/178396_images/46.jpg)
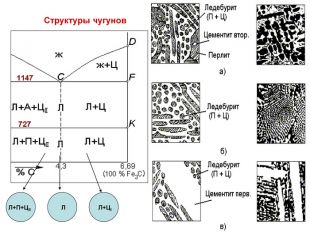
![ECF – эвтектическое (11470С) Эвтектическое превращение характеризуется следующими особенностями: в равновесии находятся три фазы: [Ж], [A], [Ц]; одновременно кристаллизуется две фазы: [A], [Ц]; температура кристаллизации постоянна и составляет 11470С; температура кристаллизации эвтектики (11470С) меньше, чем температура кристаллизации составляющих эвтектику фаз – аустенита (15390С) и цементита (~12600С и выше) Полная схема эвтектического превращения имеет вид: [Жс] ↔ Л [АЕ + ЦF] или [Ж4,3] ↔ Л [А2,14 + Ц6,67] Эвтектическая смесь аустенита и цементита называется – ледебуритом (Эвтектика – мелкодисперсная механическая смесь разнородных кристаллов, кристаллизующихся одновременно при постоянной, самой низкой для рассматриваемой системы, температуре.) ECF – эвтектическое (11470С) Эвтектическое превращение характеризуется следующими особенностями: в равновесии находятся три фазы: [Ж], [A], [Ц]; одновременно кристаллизуется две фазы: [A], [Ц]; температура кристаллизации постоянна и составляет 11470С; температура кристаллизации эвтектики (11470С) меньше, чем температура кристаллизации составляющих эвтектику фаз – аустенита (15390С) и цементита (~12600С и выше) Полная схема эвтектического превращения имеет вид: [Жс] ↔ Л [АЕ + ЦF] или [Ж4,3] ↔ Л [А2,14 + Ц6,67] Эвтектическая смесь аустенита и цементита называется – ледебуритом (Эвтектика – мелкодисперсная механическая смесь разнородных кристаллов, кристаллизующихся одновременно при постоянной, самой низкой для рассматриваемой системы, температуре.)](/uploads/files/959083/165760/178396_images/47.jpg)
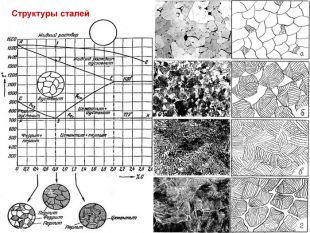
![ЛЕДЕБУРИТ Ледебурит представляет собой смесь двух фаз – аустенита и цементита; На диаграмме обозначен как Л [A+Ц]; Образуется в процессе первичной кристаллизации жидкого раствора с содержанием углерода 4,3% при постоянной температуре 11470С; Образующаяся смесь называется эвтектикой (от греч.eutektos – легкоплавкий), а приводящее к образованию смеси превращение – эвтектическим. ЛЕДЕБУРИТ Ледебурит представляет собой смесь двух фаз – аустенита и цементита; На диаграмме обозначен как Л [A+Ц]; Образуется в процессе первичной кристаллизации жидкого раствора с содержанием углерода 4,3% при постоянной температуре 11470С; Образующаяся смесь называется эвтектикой (от греч.eutektos – легкоплавкий), а приводящее к образованию смеси превращение – эвтектическим.](/uploads/files/959083/165760/178396_images/48.jpg)
![PSK – эвтектоидное (7270С) Эвтектоидное превращение имеет те же особенности, что и эвтектическое: в равновесии находятся три фазы: [А], [Ф], [Ц]; одновременно кристаллизуется две фазы: [Ф], [Ц]; температура кристаллизации постоянна и составляет 7270С. Полная схема эвтектоидного превращения имеет вид: [As] ↔ П [ФР + ЦК] или [А0,8] ↔ П [Ф0,03 + Ц6,67] Эвтектоидная смесь феррита и цементита называется – перлитом (Эвтектоид - смесь двух стабильных твердых фаз, образованных одновременно из твердого раствора при эвтектоидном распаде и имеющая постоянную для данной системы состав) PSK – эвтектоидное (7270С) Эвтектоидное превращение имеет те же особенности, что и эвтектическое: в равновесии находятся три фазы: [А], [Ф], [Ц]; одновременно кристаллизуется две фазы: [Ф], [Ц]; температура кристаллизации постоянна и составляет 7270С. Полная схема эвтектоидного превращения имеет вид: [As] ↔ П [ФР + ЦК] или [А0,8] ↔ П [Ф0,03 + Ц6,67] Эвтектоидная смесь феррита и цементита называется – перлитом (Эвтектоид - смесь двух стабильных твердых фаз, образованных одновременно из твердого раствора при эвтектоидном распаде и имеющая постоянную для данной системы состав)](/uploads/files/959083/165760/178396_images/49.jpg)
![ПЕРЛИТ Перлит представляет собой смесь двух фаз – феррита и цементита; На диаграмме обозначен как П[Ф+Ц]; Образуется при медленном охлаждении в процессе вторичной кристаллизации аустенита, содержащего 0,8% углерода при постоянной температуре 7270С; Образующаяся смесь называется эвтектоидом, а приводящее к образованию смеси превращение – эвтектоидным. ПЕРЛИТ Перлит представляет собой смесь двух фаз – феррита и цементита; На диаграмме обозначен как П[Ф+Ц]; Образуется при медленном охлаждении в процессе вторичной кристаллизации аустенита, содержащего 0,8% углерода при постоянной температуре 7270С; Образующаяся смесь называется эвтектоидом, а приводящее к образованию смеси превращение – эвтектоидным.](/uploads/files/959083/165760/178396_images/50.jpg)


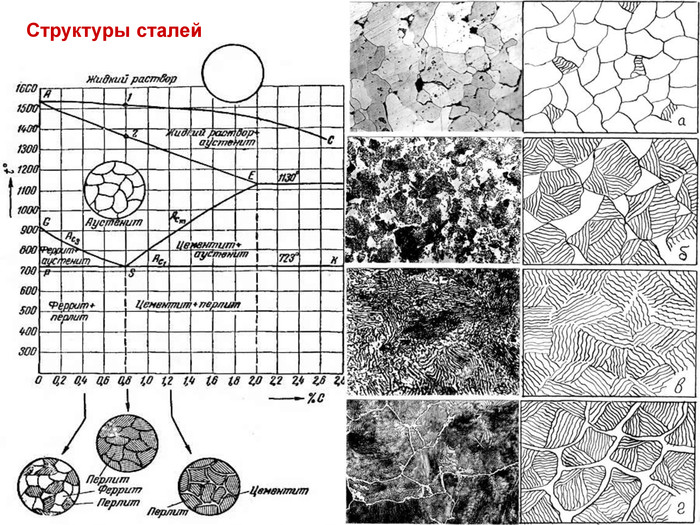
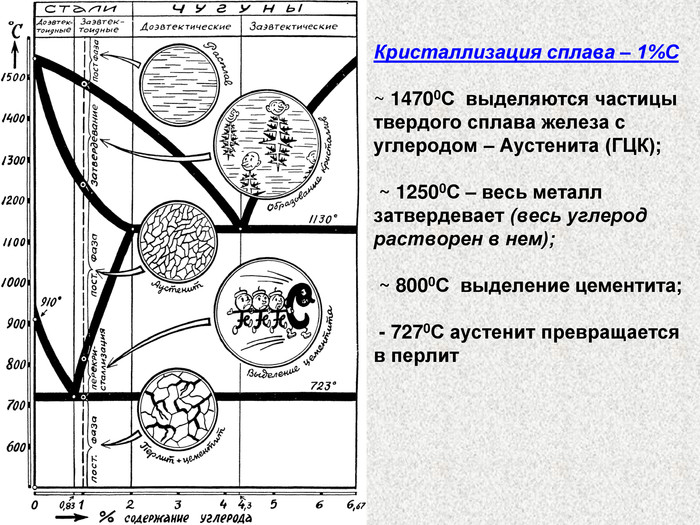
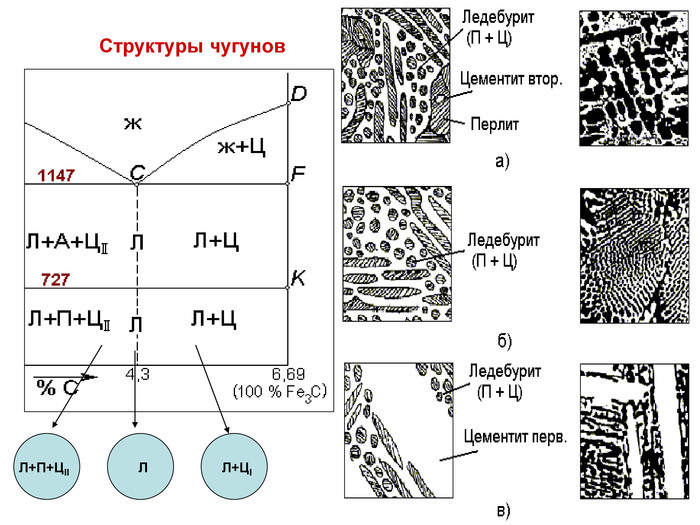
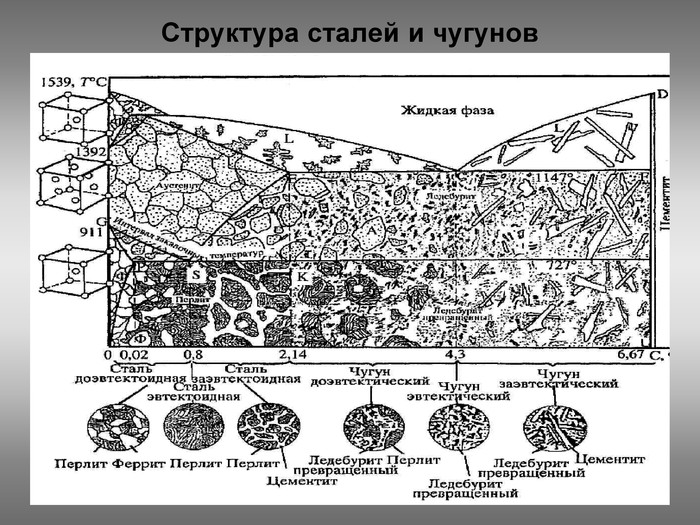
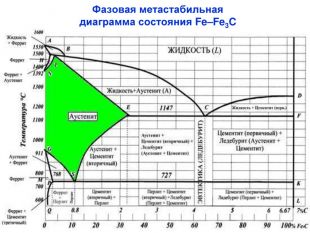
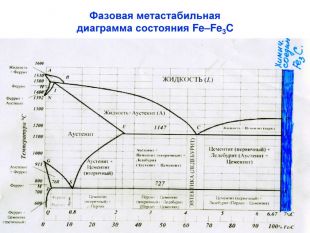
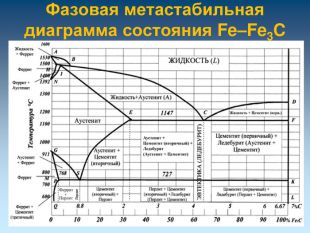
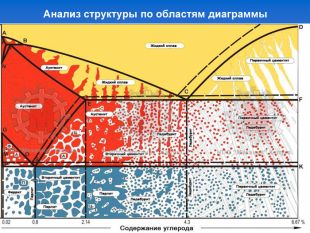
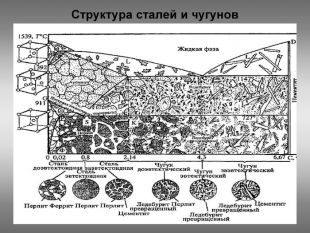
Стали и чугуны – важнейшие металлические сплавы современной техники. Производство чугуна и стали по объему превосходит производство всех других металлов вместе взятых более чем в 10 раз. Диаграмма состояний железо-углерод дает основное представление о строении железоуглеродистых сплавов – сталей и чугунов.
По диаграмме можно определять структуру железоуглеродистых сплавов с любым содержанием углерода при любой заданной температуре. Диаграмма дает много важной информации о поведении сплавов железо—углерод при нагреве и охлаждении. Знания о марках и свойствах металлов и сплавов, способность использовать их во время технического обслуживания и ремонта оборудования
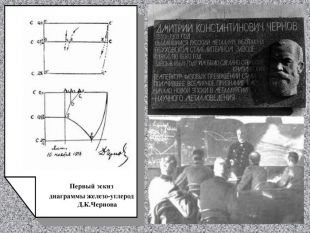
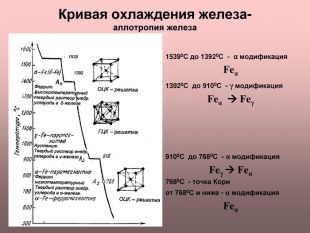
Чернов совершил своё главное открытие в 1866—1868 годах. Он установил, что при изменении температуры сталь меняет свои свойства и проходит полиморфические превращения. Чернов вычислил точки, известные сейчас как точки Чернова. Чернов Д.К. Основоположник металловедения и термической обработки стали. Установил влияние термообработки стали на её структуру и свойства. Создал стройную систему кристаллизации стального литья.
Павел Петрович Аносов (1799-1851) Русский металлург. Разработал технологический процесс выплавки стали, положил начало металлургии легированных сталей, разгадал загадку знаменитой булатной стали. Впервые (1831 г.) применил микроскоп. Много сделал для превращения металлургии из ремесла в науку.
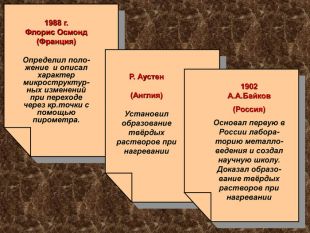
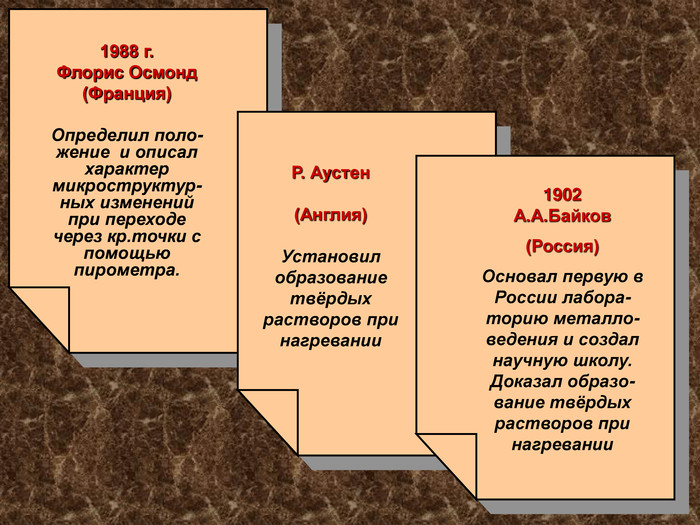
1988 г. Флорис Осмонд (Франция) Определил поло-жение и описал характер микроструктур-ных изменений при переходе через кр.точки с помощью пирометра. Р. Аустен (Англия) Установил образование твёрдых растворов при нагревании 1902 А.А.Байков (Россия) Основал первую в России лабора-торию металло-ведения и создал научную школу. Доказал образо-вание твёрдых растворов при нагревании 1988 г. Флорис Осмонд (Франция) Определил поло-жение и описал характер микроструктур-ных изменений при переходе через кр.точки с помощью пирометра.
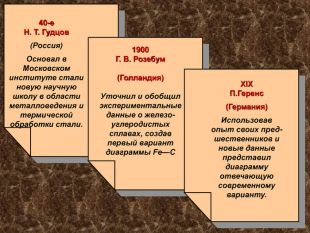
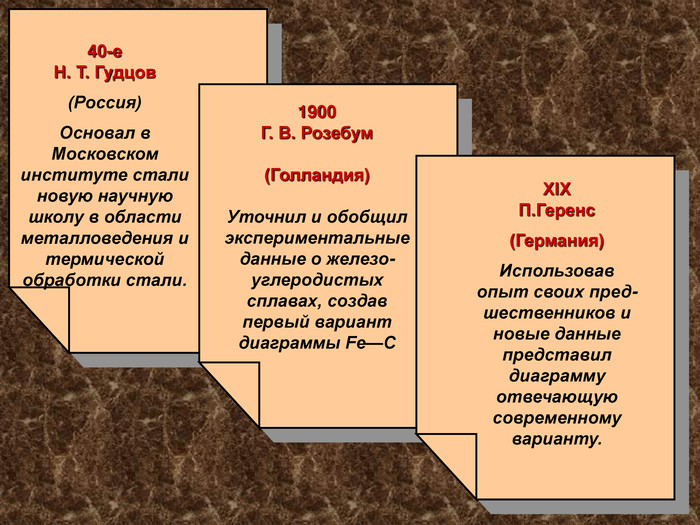
40-е Н. Т. Гудцов (Россия) Основал в Московском институте стали новую научную школу в области металловедения и термической обработки стали. 1900 Г. В. Розебум (Голландия) Уточнил и обобщил экспериментальные данные о железо-углеродистых сплавах, создав первый вариант диаграммы Fe—С ХІХ П.Геренс (Германия) Использовав опыт своих пред-шественников и новые данные представил диаграмму отвечающую современному варианту.
механические смеси образуют компоненты сплава с большим различием атомных диаметров, не способные к взаимному растворению в твердом состоянии и не вступающие в химическую реакцию. Каждый из компонентов сохраняет свой тип кристаллической решетки. Свойства М.с. - промежуточные между свойствами элементов, в него входящих.
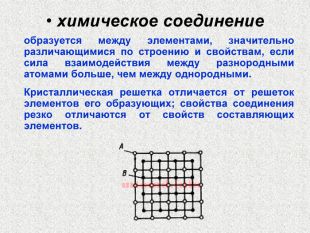
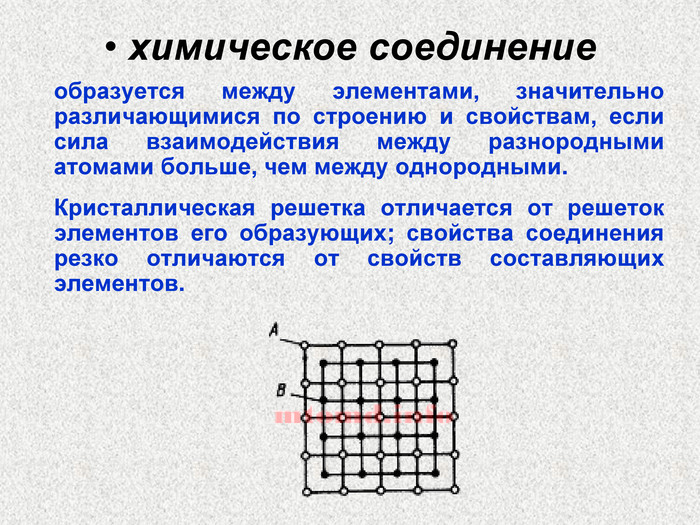
химическое соединение образуется между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными. Кристаллическая решетка отличается от решеток элементов его образующих; свойства соединения резко отличаются от свойств составляющих элементов.
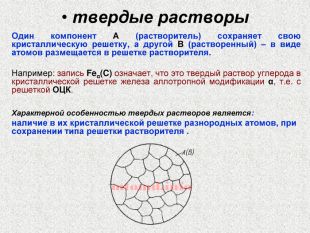
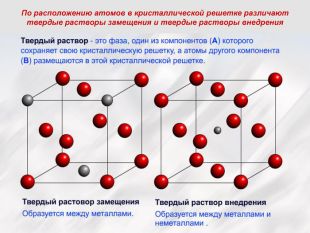
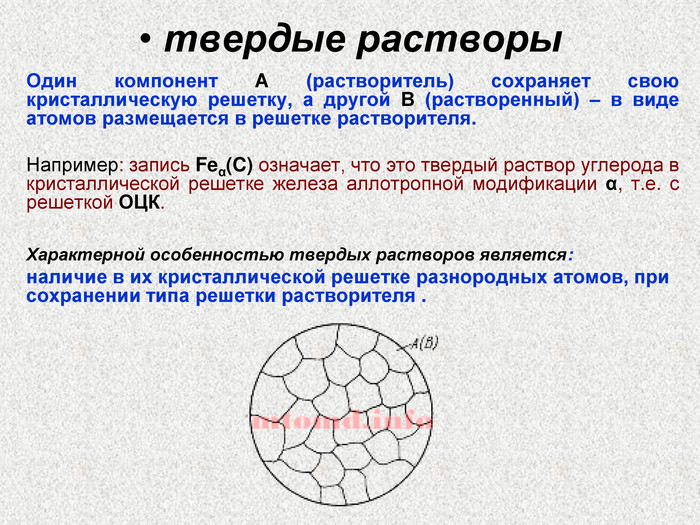
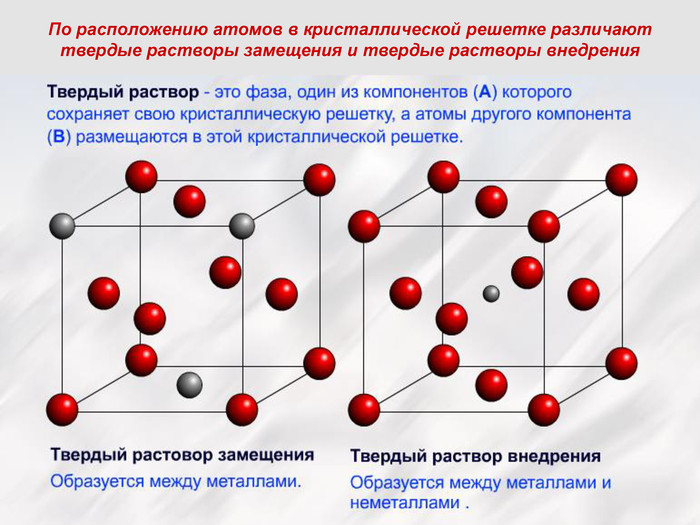
твердые растворы Один компонент А (растворитель) сохраняет свою кристаллическую решетку, а другой В (растворенный) – в виде атомов размещается в решетке растворителя. Например: запись Feα(C) означает, что это твердый раствор углерода в кристаллической решетке железа аллотропной модификации α, т.е. с решеткой ОЦК. Характерной особенностью твердых растворов является: наличие в их кристаллической решетке разнородных атомов, при сохранении типа решетки растворителя .
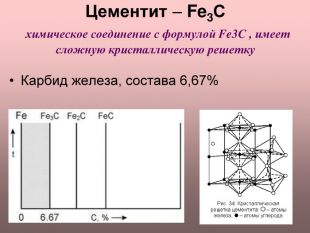
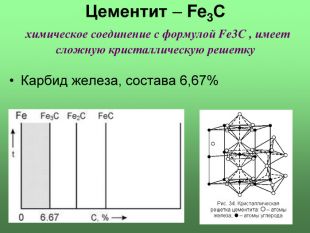
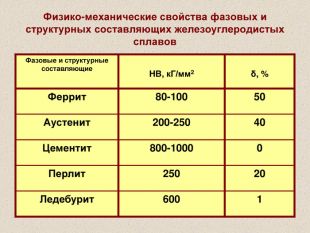
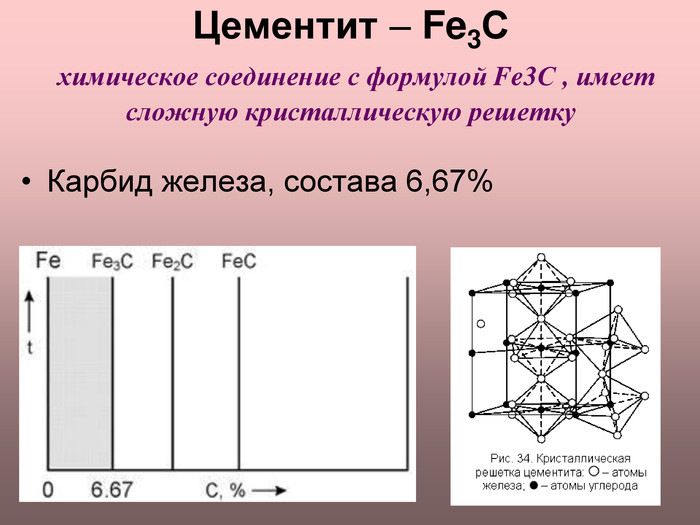
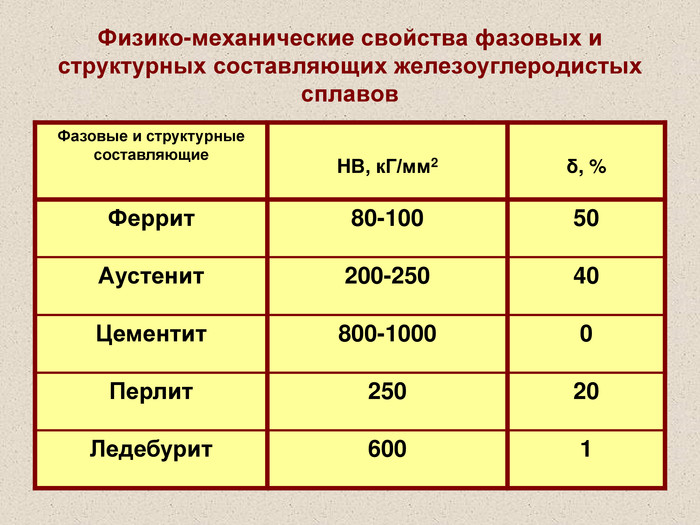
Цементит (Fe3С) химическое соединение, карбид железа, аллотропических превращений не испытывает, концентрация углерода 6,67% температура плавления ~ 12600С твердость по Бринеллю 800 кГ/мм2 пластичность δ = 0%; слабо магнитен до 210°C Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита
Фазы в сплавах Fe-C (однородная часть системы, отделенная от других частей системы поверхностью раздела, при переходе через которую структура и свойства резко меняются. Фазами могут быть отдельные металлы, их химические соединения, а также твердые и жидкие растворы на основе металлов) жидкий раствор –[Ж] феррит – [Ф] аустенит – [А] цементит – [Ц] свободный углерод в виде графита – [Гр]
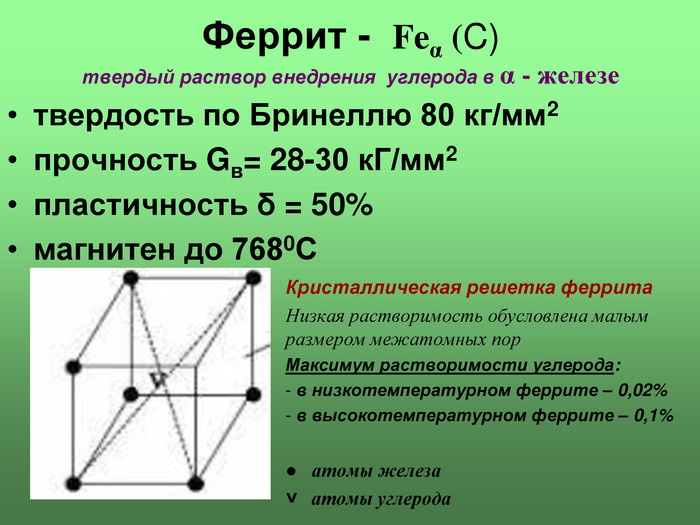
Феррит - Feα (C) твердый раствор внедрения углерода в α - железе Кристаллическая решетка феррита Низкая растворимость обусловлена малым размером межатомных пор Максимум растворимости углерода: в низкотемпературном феррите – 0,02% в высокотемпературном феррите – 0,1% ● атомы железа ˅ атомы углерода твердость по Бринеллю 80 кг/мм2 прочность Gв= 28-30 кГ/мм2 пластичность δ = 50% магнитен до 7680С
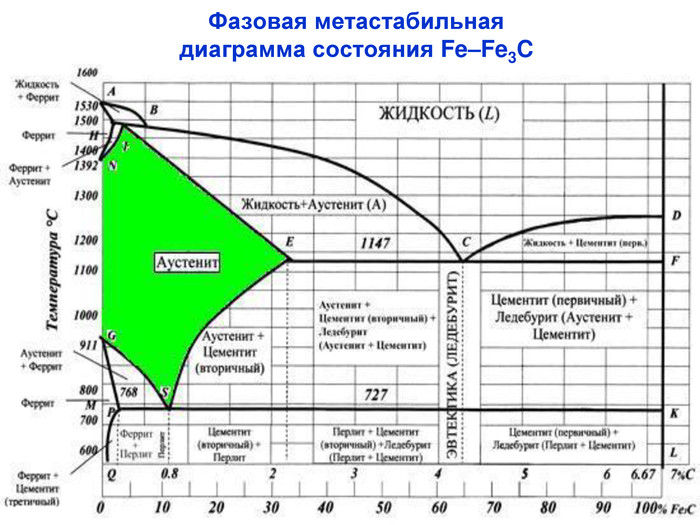
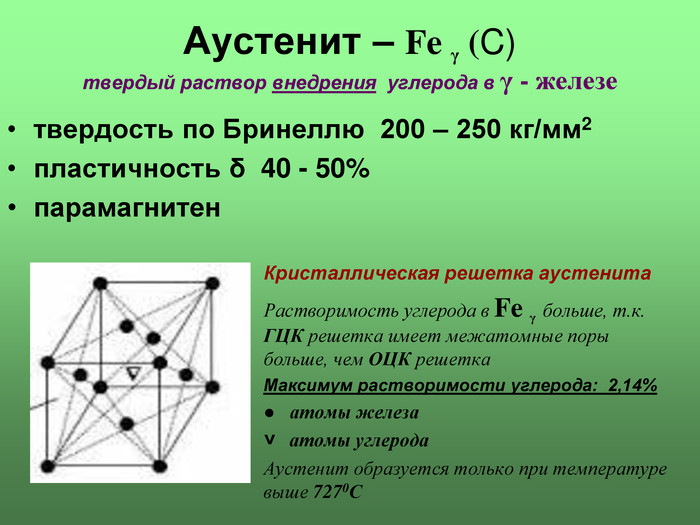
Аустенит – Fe γ (C) твердый раствор внедрения углерода в γ - железе Кристаллическая решетка аустенита Растворимость углерода в Fe γ больше, т.к. ГЦК решетка имеет межатомные поры больше, чем ОЦК решетка Максимум растворимости углерода: 2,14% ● атомы железа ˅ атомы углерода Аустенит образуется только при температуре выше 7270С твердость по Бринеллю 200 – 250 кг/мм2 пластичность δ 40 - 50% парамагнитен
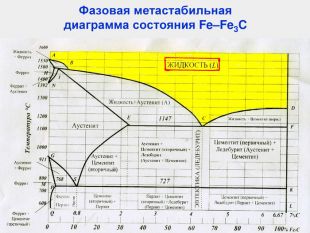
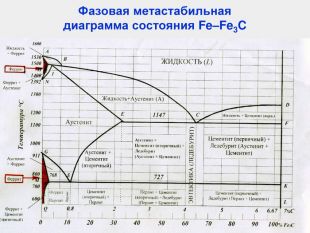
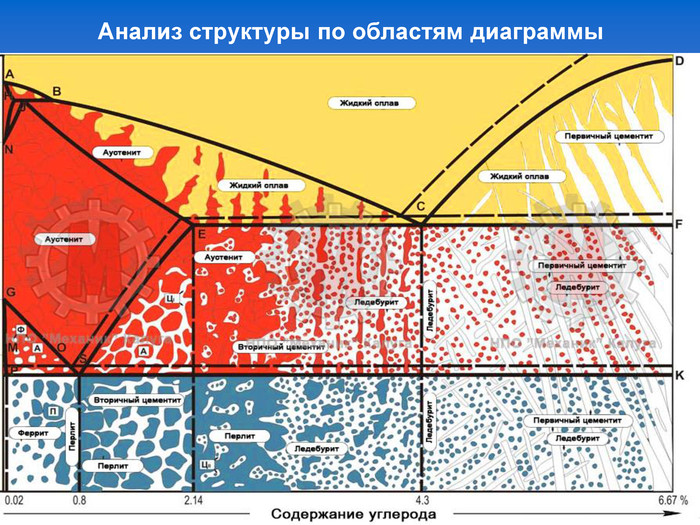
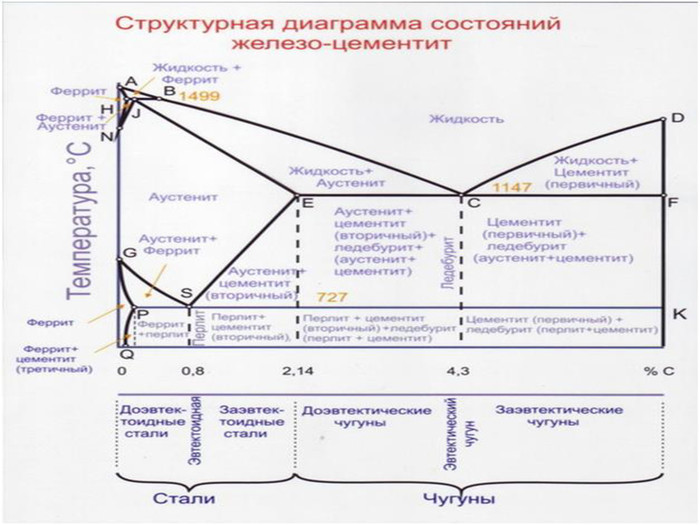
Характерные линии диаграммы состояния Fe-Fe3C ABCD - начала кристаллизации сплава (ликвидус) AHJECF - конца кристаллизации сплава (солидус) Закристаллизовавшиеся сплавы состоят из трех фаз в разном их сочетании: [A], [Ф], [Ц] В системе Fe-Fe3C происходят три изотермических превращения: HJB – перитектическое (14990С) Фн +Жв Aj ECF – эвтектическое (11470С) Жс АЕ + Ц PSK – эвтектоидное (7270С) АS Фр + Ц
ECF – эвтектическое (11470С) Эвтектическое превращение характеризуется следующими особенностями: в равновесии находятся три фазы: [Ж], [A], [Ц]; одновременно кристаллизуется две фазы: [A], [Ц]; температура кристаллизации постоянна и составляет 11470С; температура кристаллизации эвтектики (11470С) меньше, чем температура кристаллизации составляющих эвтектику фаз – аустенита (15390С) и цементита (~12600С и выше) Полная схема эвтектического превращения имеет вид: [Жс] ↔ Л [АЕ + ЦF] или [Ж4,3] ↔ Л [А2,14 + Ц6,67] Эвтектическая смесь аустенита и цементита называется – ледебуритом (Эвтектика – мелкодисперсная механическая смесь разнородных кристаллов, кристаллизующихся одновременно при постоянной, самой низкой для рассматриваемой системы, температуре.)
ЛЕДЕБУРИТ Ледебурит представляет собой смесь двух фаз – аустенита и цементита; На диаграмме обозначен как Л [A+Ц]; Образуется в процессе первичной кристаллизации жидкого раствора с содержанием углерода 4,3% при постоянной температуре 11470С; Образующаяся смесь называется эвтектикой (от греч.eutektos – легкоплавкий), а приводящее к образованию смеси превращение – эвтектическим.
PSK – эвтектоидное (7270С) Эвтектоидное превращение имеет те же особенности, что и эвтектическое: в равновесии находятся три фазы: [А], [Ф], [Ц]; одновременно кристаллизуется две фазы: [Ф], [Ц]; температура кристаллизации постоянна и составляет 7270С. Полная схема эвтектоидного превращения имеет вид: [As] ↔ П [ФР + ЦК] или [А0,8] ↔ П [Ф0,03 + Ц6,67] Эвтектоидная смесь феррита и цементита называется – перлитом (Эвтектоид - смесь двух стабильных твердых фаз, образованных одновременно из твердого раствора при эвтектоидном распаде и имеющая постоянную для данной системы состав)
ПЕРЛИТ Перлит представляет собой смесь двух фаз – феррита и цементита; На диаграмме обозначен как П[Ф+Ц]; Образуется при медленном охлаждении в процессе вторичной кристаллизации аустенита, содержащего 0,8% углерода при постоянной температуре 7270С; Образующаяся смесь называется эвтектоидом, а приводящее к образованию смеси превращение – эвтектоидным.
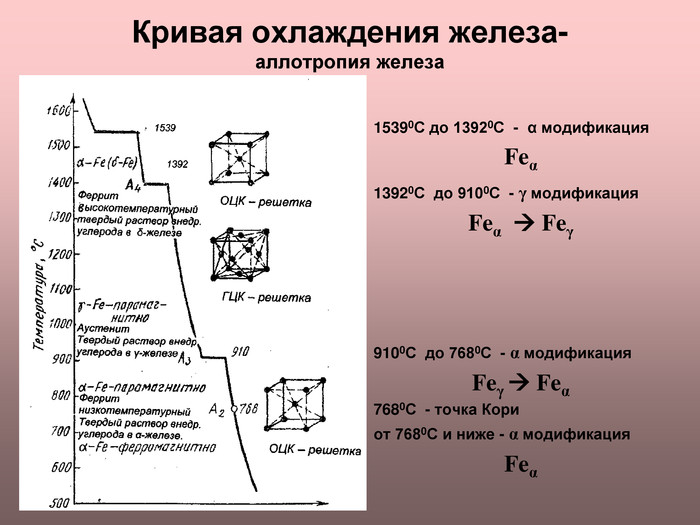
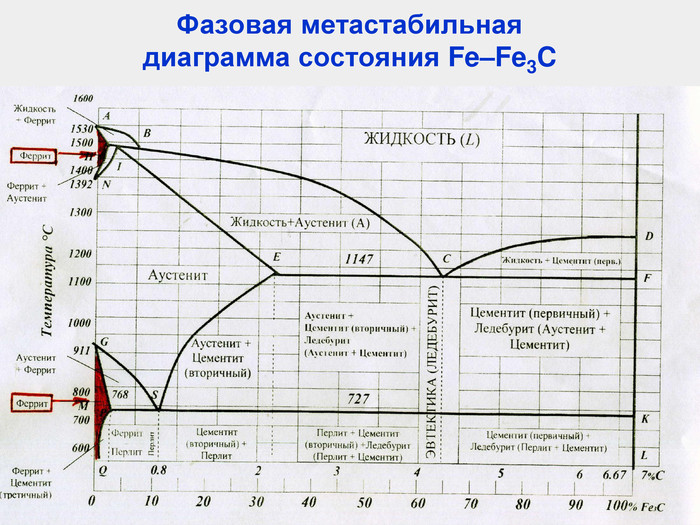
Характерные линии диаграммы состояния Fe-Fe3C NH и NJ – линии полиморфного превращения А4 GP и GS – линии полиморфного превращения А3 ES – линии ограниченной растворимости углерода в аустените PQ – линии ограниченной растворимости углерода в феррите DFKL – линия показывает, что Fe3C имеет постоянную концентрацию при любой температуре МО – Переход из ферромагнитного в парамагнитное состояние, точка Кюри
Характерные точки диаграммы состояния Fe-Fe3C Точка t, 0C C, % Характеристика А 1539 0 точка плавления железа Н 1499 0,1 точка предельного насыщения углеродом α-феррита ( ↑ t0C) ( δ-феррит) при температуре перитектического превращения J 1499 0,16 точка трехфазного равновесия B 1499 0,51 предельная растворимость углерода в α-феррита ( ↑ t0C) N 1392 0 точка полиморфного превращения в чистом железе γ↔α (1392 °С), соответствует для чистого железа критической точке А4 D 1260 6,67 точка плавления цементита E 1147 2,14 точка, отвечающая предельному содержанию углерода в аустените, находящемся в равновесии с цементитом и жидкостью. Границей между сталями и чугунами. C 1147 4,3 точка трехфазного равновесия, из жидкого сплава одн.крист. А и Ц1, образуя эвтектику - Л F 1147 6,67 точка предельного насыщения цементита железом при эвтектической температуре (1147°С), концентрация углерода близка к 6,67 % G 911 0 точка полиморфного превращения в чистом железе α↔γ (911 °С), соответствует для чистого железа критической точке А3. Число степеней свободы равно нулю P 727 0,025 точка предельного насыщения углеродом α-феррита (при↑ t0C) S 727 0,8 Точка трехфазного равновесия, А испытывает эвтектоидное превращение, одновр.кристал. две фазы: феррит и цементит, называемый перлит K 727 6,67 Q 20 0,006 растворимость углерода в феррите при комнатной температуре
-
 Омельченко Леонід 21.10.2022 в 13:26Дуже сподобалась хронологія подачі матеріалу. Гарна наглядність. Добре сплановане повторювання дає змогу закріпити отриману інформацію. Ця презентація є методикою створення призентвцій для лекцій.Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Омельченко Леонід 21.10.2022 в 13:26Дуже сподобалась хронологія подачі матеріалу. Гарна наглядність. Добре сплановане повторювання дає змогу закріпити отриману інформацію. Ця презентація є методикою створення призентвцій для лекцій.Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку