Презентація до дистанційного уроку
Про матеріал
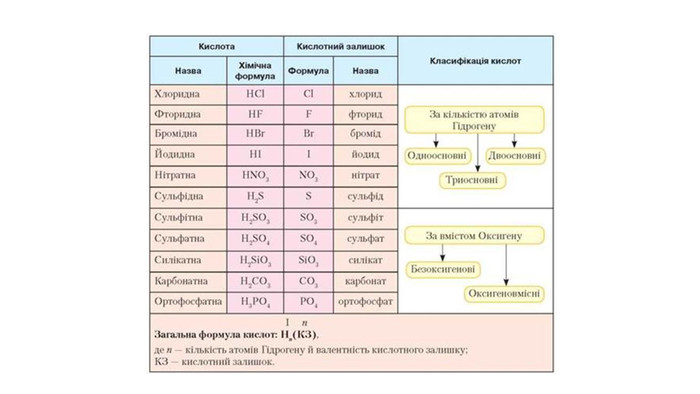
1.Сформулюйте визначення поняття «кислоти» та класифікуйте їх за вмістом Гідрогену й Оксигену.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку