Теоретичний матеріал для вивчення теми Алкани

Алкани або насичені вуглеводні - це такі вуглеводні, в молекулах яких всі атоми карбону з’єднані одинарними зв’язками та насичені воднем.
Склад алканів виражається загальною формулою CnH2n+2.
Вони утворюють гомологічний ряд - це ряд сполук схожої будови і хімічних властивостей, в якому кожний наступний член відрізняється від попереднього на групу атомів СН2. Група СН2 називається гомологічною різницею ряду, а представники цього ряду - гомологами.
Гомологічний ряд алканів
|
Алкан |
Назва |
Радикал |
Назва |
|
СН4 |
Метан |
СН3 |
Метил |
|
С2Н6 |
Етан |
С2Н5 |
Етил |
|
С3Н8 |
Пропан |
С3Н7 |
Пропил |
|
С4Н10 |
Бутан |
С4Н9 |
Бутил |
|
С5Н12 |
Пентан |
С5Н11 |
Пентил |
|
С6Н14 |
Гексан |
С6Н13 |
Гексил |
|
С7Н16 |
Гептан |
С7Н15 |
Гептил |
|
С8Н18 |
Октан |
С8Н17 |
Октил |
|
С9Н20 |
Нонан |
С9Н19 |
Нонил |
|
С10Н22 |
Декан |
С10Н21 |
Декил |
При розриві ковалентного зв'язку карбону з одним з атомів водню по вільнорадикальному способу утворюються одновалентні радикали алканів із загальною формулою CnH2n+1 (дивись таблицю).
Молекули алканів утворені ковалентними σ С-С і σ С-Н зв'язками.
 Так як валентний кут між σ зв'язками дорівнює 109о28', то молекули алканів мають просторову будову. Наприклад, молекула метану має форму тетраедра.
Так як валентний кут між σ зв'язками дорівнює 109о28', то молекули алканів мають просторову будову. Наприклад, молекула метану має форму тетраедра.
У алканів sp3 гібридизація.
Вуглецевий скелет алканів, починаючи з пропану буде зигзагоподібним.
Для алканів починаючи з бутану, властива ізомерія. Вона визначається розгалуженням карбонового ланцюга (скелету). Алкани з лінійним розташуванням атомів вуглецю називають нормальними, а з розгалуженим - ізомерами.
![]()
l
![]()
норм.бутан ізо-бутан
Для назв ізомерів застосовують дві номенклатури:
- стару - раціональну, по якій алкани розглядаються як похідні метану, у якого один або кілька атомів водню заміщені радикалами. Якщо однакові радикали повторюються кілька разів, то їх вказують грецькими числівниками ди-, три-, тетра- ...
![]()
l
![]() триметилтеман
триметилтеман
- систематичну (міжнародну, Женевську)
Ознайомлення з міжнародною номенклатурою органічних сполук IUPAC
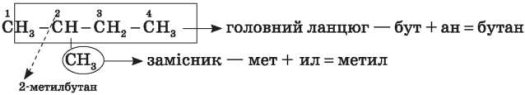
1. У структурній формулі вуглеводню знаходимо головний ланцюг. Головний ланцюг — це найдовша безперервна послідовність атомів Карбону.
2. Частинки, що не ввійшли до головного ланцюга, — замісники.
3. Головний ланцюг нумерується з того кінця, до якого ближче замісники або кратний зв’язок. Якщо різні замісники розташовані однаково до обох кінців головного ланцюга, то нумерація йде з того боку, до якого ближче замісник з меншою кількістю атомів карбону, або головніший замісник (Cl, Br і т.д.). Цифри біля атомів карбону мають назву локанти.
4. Вказуємо місце розташування цифрами на назви замісників.
5. Назва насиченого вуглеводню: номер атома головного ланцюга, біля якого є замісник, — назва замісника + назва головного ланцюга + суфікс -ан. Наприклад:
6. Якщо до головного ланцюга приєднано кілька однакових замісників, то в назві цифрою вказується положення кожного з них, а перед назвою замісника ставляться префікси: ди- (два замісники), три- (три замісники), тетра- (чотири замісники) і т. д. Якщо два однакові замісники перебувають біля одного атома головного ланцюга, то в назві його номер пишеться двічі.
7. Якщо до головного ланцюга приєднано кілька різних замісників, то в назві вони перелічуються за абеткою.
Фізичні властивості алканів
С1-С4 за звичайних умов – гази, С5-С17 – рідини, починаючи з С18 – тверді речовини. Алкани практично нерозчинні у воді, але добре розчиняються в неполярних розчинниках, наприклад, в бензолі. Так, метан СН4(болотний, рудничий газ) – газ без кольору та запаху, добре розчинний в етанолі, ефірі, вуглеводнях, але погано розчинний у воді.
Хімічні властивості
При звичайних умовах алкани хімічно інертні — не реагують з кислотами, ні з лугами. Це пояснюється високою міцністю сигма-зв’язків С-С і С-Н. Неполярні зв’язки С-С і С-Н здатні розщеплюватися тільки гомолітично під дією активних вільних радикалів. Тому алкани вступають у реакції, що протікають за механізмом заміщення. В першу чергу заміщують атоми водню у третинних, потім у вторинних і первинних атомів вуглецю.
1. Галогенування. При взаємодії алканів з хлором і бромом при дії УФ-випромінювання або високої температури утворюється суміш продуктів від моно- до полігалогенпохідних алканів:
CH4 + Cl2 → CH3Cl + HCl - монохлорметан
CH3Cl + Cl2 → CH2Cl2 + HCl - дихлорметан
CH2Cl2 + Cl2 → CHCl3 + HCl - трихлорметан
CHCl3 + Cl2 → CCl4 + HCl – тетрахлорметан
2. Нітрування (реакція Коновалова). При дії розбавленої азотної кислоти на алкани при 1400 і невеликому тиску протікає радикальна реакція:
СН3-СН3 +НNO3 → СН3-СН2-NО2 (нітроетан) + Н2О
3. Горіння в атмосфері кисню з утворенням CO2 ↑ + H2O
CH4 + 2O2 → CO2 ↑ + H2O
4. Ізомеризація. При нагріванні в присутності AlCl3 алкани, починаючи з бутану, підвергаються ізомеризації
CH3 – CH2 – CH2 – CH3 → CH3 – CH – CH3
|
CH3
5. Піроліз. Алкани при сильному нагріванні без доступу повітря розкладаються з утворенням сажі і водню (термічний розклад)
CH4 → C + 2H2
6. Дегідрування. Починаючи з етану, алкани при нагріванні в присутності каталізатора нікелю або платини піддаються відщепленню атомів водню:
C4H10 → C4H8 + H2↑
7. Крекінг (розрив ланцюга атомів карбону):
С4H10 → C2H6↑ + C2H4↑
Способи добування алканів
У промисловості:
1. Основне джерело алканів – природний газ, нафта, кам’яне вугілля.
2. Переробка синтез-газу за наявності каталізаторів
СО + Н2 → Н2О + суміш вуглеводнів
3. Нагріванням вуглецю з воднем
С + 2Н2 → СН4
У лабораторії:
1.Термічний крекінг алканів:
С8Н18 → С4Н10 ↑ + С4Н8 ↑
2.Гідрування алкенів, алкінів, алкадієнів
С2Н4 + Н2 → С2Н6
3.Реакція Вюрца – на першій стадії отримуємо хлорзаміщені алкани (першої стадії), на другій стадії – взаємодія хлорпохідних алканів з натрієм.
С2Н5Сl + 2Na + С2Н5Сl → С4Н10 + NaCl
Метан СН4
Є складовою частиною природних газів, утворюється при повільному розкладанні рослинних залишків без доступу повітря. Виділяється з дна боліт і з кам'яновугільних пластів. Тому його називають болотним або рудниковим газом. Це газ без кольору і запаху. Молекулярна маса - 16.
Завдяки великій теплотворній здатності його застосовують як паливо в побуті і в промисловості. При неповному термічному розкладанні метану утворюється ацетилен і водень, при повному - сажа і водень, які служать вихідним сировиною для виробництва формальдегіду, метанолу та ін. речовин.
Добування метану:
1. У лабораторії метан отримують при нагріванні суміші ацетату натрію з гідроксидом натрію (200оС) СН3СООН + NaОН → Na2СО3 + СН4↑
2.При взаємодії карбіду алюмінію з водою Al4С3 + 12Н2О → 4Al(ОН)3 + 3СН4 ↑
3.Синтезом з карбону і водню: С + 2Н2 → СН4 ↑
4. З природного газу - в промисловості.
Особливі хімічні властивості метану
НЕ піддається ізомеризації, дегідруванню. Крім галогенування, горіння і повного термічного розкладання, метан піддається
1. Неповний термічний розклад: 2CH4 → C2H2 ↑ + 3H2 ↑ етин та водень
2. Окислення з утворенням формальдегіду: CH4 → HCOH + H2O
3. Утворення водню під дією водяної пари:CH4 + H2O → CO ↑ + 3H2 ↑
Застосування алканів.
Метан використовують в якості висококалорійного палива у складі природного газу, в якості сировини для виробництва водню, ацетилену, хлороформу та інших органічних речовин у промислових масштабах.
Пропан С3Н8 і бутан С4Н10 – гази, що застосовуються в побуті, як балонний газ. Пропан використовується в якості автомобільного палива, оскільки є більш екологічно чистим, ніж бензин.
Бутан – сировина для одержання 1,3–бутадієну, що використовується у виробництві синтетичного каучуку.
Основним природним джерелом цих речовин є такі цінні продукти, як природний газ і нафта. Області застосування алканів на сьогоднішній день дуже широкі і різноманітні. Наприклад, газоподібні речовини використовують як цінне джерело палива. Ще одне джерело алканів - нафта, значення якої для сучасного людства переоцінити важко. До нафтових продуктів відносять: бензини - використовуються в якості палива; гас; дизельне паливо, або легкий газойль; важкий газойль, який застосовують в якості мастила; залишки нафтової перегонки використовують для виготовлення асфальту. Нафтові продукти також використовуються для отримання пластмас, синтетичних волокон, каучуків і деяких миючих засобів.
Але застосування алканів набагато ширше. Деякі рідкі форми цих речовин використовуються як розчинники, а також в якості ракетного палива.
Вазелін і вазелінове масло - продукти, які складаються з суміші алканів. Їх використовують в медицині і косметології (в основному для приготування мазей і кремів), а також в парфумерії.
Парафін - ще один всім відомий продукт, який є сумішшю твердих алканів. Це тверда біла маса, температура топлення якої становить 50 - 70 градусів. У сучасному виробництві парафін використовується для виготовлення свічок. Цією ж речовиною просочують сірники. У медицині за допомогою парафіну проводять різного роду теплові процедури.
CH3Cl – в холодильних установках;
CH2Cl2, CCl4 – розчинники;
CH3Cl – хлороформ – в медицині для наркозу
C2H5Cl – хлоретил – для місцевої анестезії
CHI3 – йодоформ – як зовнішній антисептик.
1

про публікацію авторської розробки
Додати розробку
