Презентація до теми " Амінокислоти. Білки."
Презентація до теми " Амінокислоти. Білки." Дає можливісь учням отримати загальне уявлення про будову, властивості та функції амінокислот та білків в живому організмі.



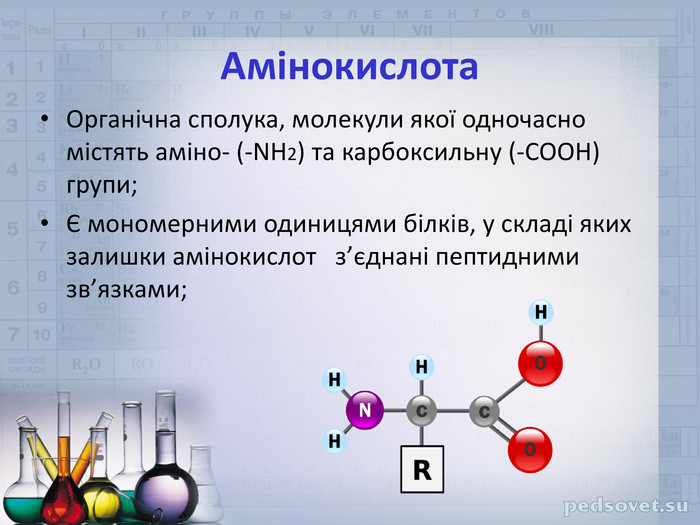
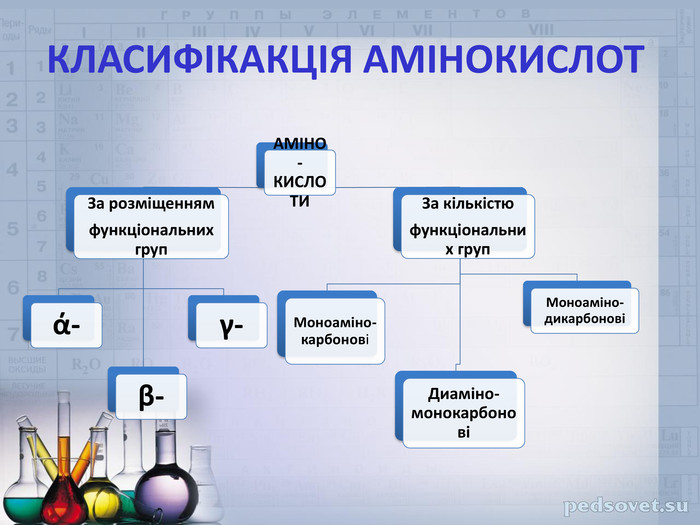







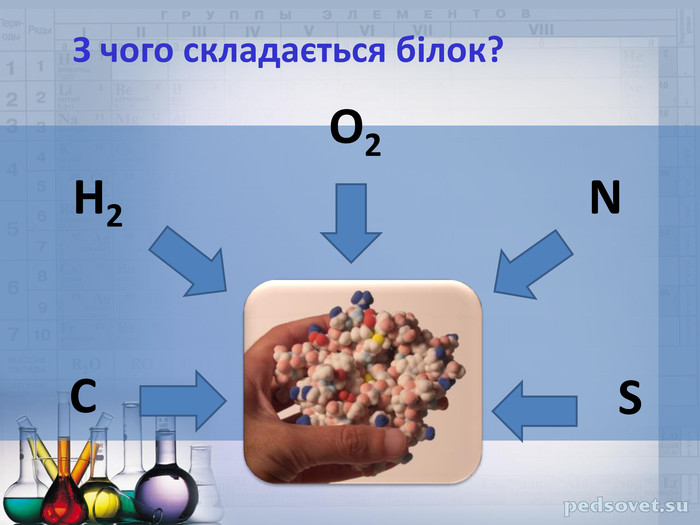
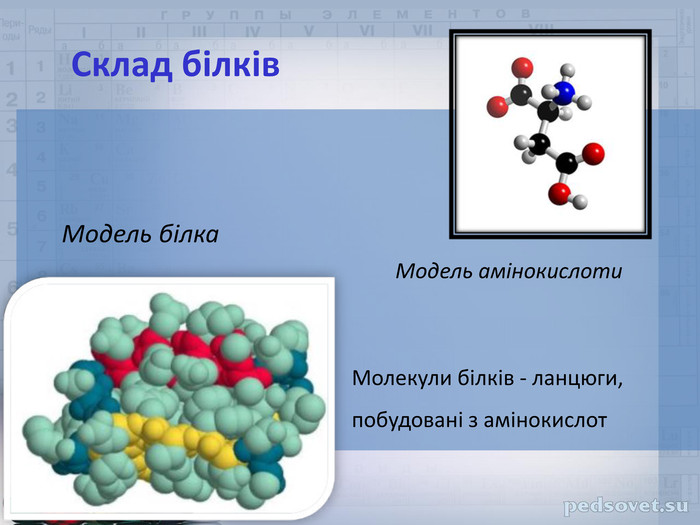



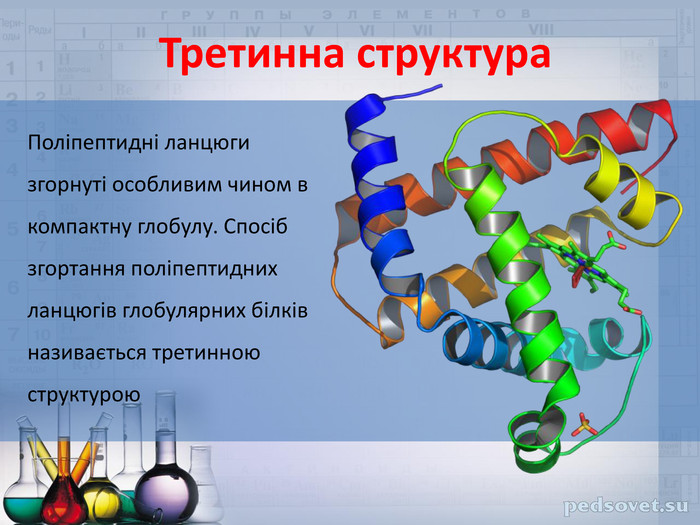





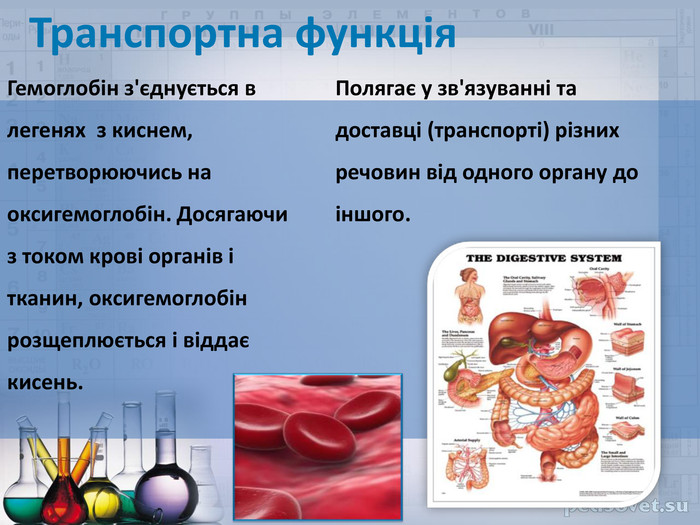





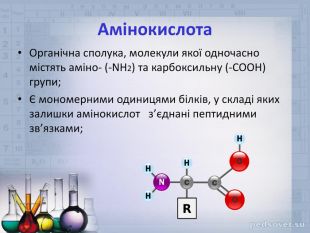
ФІЗИЧНІ ВЛАСТИВОСТІТверді кристалічні речовини. Мають високі температури плавлення. Добре розчиняються у воді. Мають різний смак: солодкий, гіркий або зовсім без смаку; все залежить від радикала – R в молекулі амінокислоти. Цим властивостям відповідає структура амінокислот як внутрішніх солей, тому їхні формули часто записують у вигляді біполярного йона: Н3 N⁺-СН2-СОО¯↔Н2 N-СН2-СООН
Функції амінокислот. Деякі з 20-ти протеїногенних амінокислот називаються «незамінними» — це такі, що не виробляються в організмі і повинні надходити з їжею. Для людини це лізин, лейцин, ізолейцин, метіонін, фенілаланін, треонін, триптофан, валін, а для дітей також гістидин та аргінін.
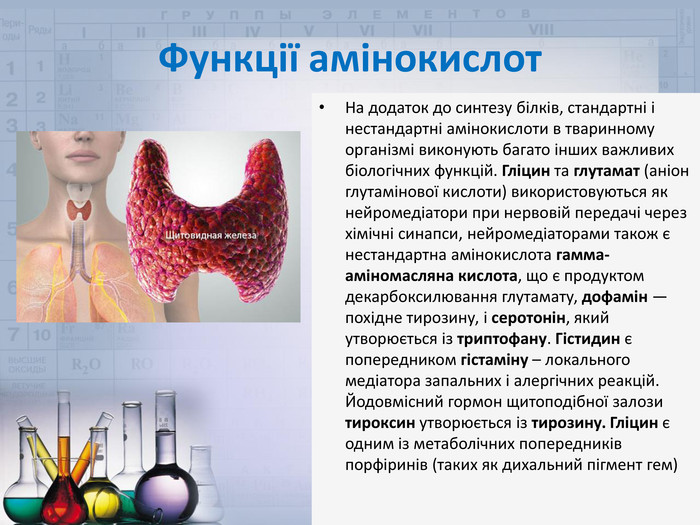
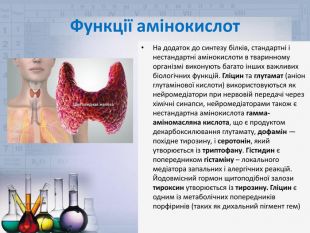
Функції амінокислот. На додаток до синтезу білків, стандартні і нестандартні амінокислоти в тваринному організмі виконують багато інших важливих біологічних функцій. Гліцин та глутамат (аніон глутамінової кислоти) використовуються як нейромедіатори при нервовій передачі через хімічні синапси, нейромедіаторами також є нестандартна амінокислота гамма-аміномасляна кислота, що є продуктом декарбоксилювання глутамату, дофамін — похідне тирозину, і серотонін, який утворюється із триптофану. Гістидин є попередником гістаміну – локального медіатора запальних і алергічних реакцій. Йодовмісний гормон щитоподібної залози тироксин утворюється із тирозину. Гліцин є одним із метаболічних попередників порфіринів (таких як дихальний пігмент гем)
Використання амінокислот. Амінокислоти знаходять широке застосування в якості харчових добавок. Наприклад, на лізин, триптофан, треонін і метіоніном збагачують корми сільськогосподарських тварин, додавання натрієвої солі глутамінової кислоти (глутамату натрію) надає ряду продуктів м'ясний смак.
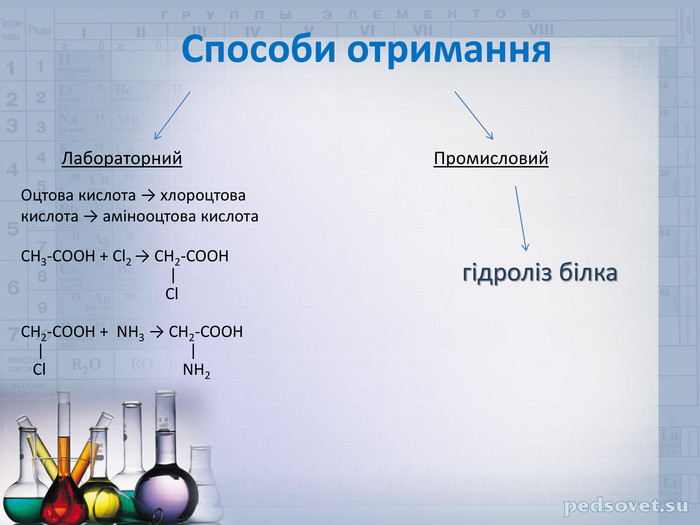
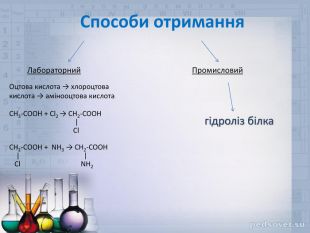
У суміші або окремо амінокислоти застосовують у медицині , у тому числі при порушеннях обміну речовин і захворюваннях органів травлення , при деяких захворюваннях центральної нервової системи ( γ - аміномасляна і глутамінова кислоти , ДОФА ) . Амінокислоти використовуються при виготовленні лікарських препаратів , барвників , в парфумерної промисловості , у виробництві миючих засобів , синтетичних волокон і плівки і т. д. Для господарських та медичних потреб амінокислоти отримують за допомогою мікроорганізмів шляхом так званого мікробіологічного синтезу (лізин , триптофан , треонін ) ; їх виділяють також з гідролізатів природних білків ( пролін , цистеїн , аргінін , гістидин ) . Але найбільш перспективні змішані способи отримання, що суміщають методи хімічного синтезу та іспользованіеферментов .


про публікацію авторської розробки
Додати розробку

























-

Полуда Тетяна Олександрівна
04.05.2023 в 19:31
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Салімон Галина Максимівна
21.04.2023 в 12:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гончарова Тетяна Олександрівна
28.04.2021 в 09:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
21.04.2021 в 14:25
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пінчук Галина
20.04.2021 в 06:50
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ivanenko Olena
19.04.2021 в 07:54
Дуже дякую. Презентація чудова, допомогла в підготовці до уроку.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Холодар Людмила Олександрівна
15.04.2021 в 10:34
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дерев'янко Людмила Василівна
15.04.2021 в 10:21
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гевел Дар'я Олександрівна
28.04.2020 в 09:39
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Туровець Олександр Антонович
12.04.2019 в 10:41
Чудова презентація
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 7 відгуків