Презентація до уроків "Тіло, матеріал, речовина, молекули, атоми. Властивості речовин". Хімія. 7 клас
Допоміжна презентація до уроків для 7 класу. У змісті презентації містяться задачі та запитання, самостійні міні-роботи до різних уроків з хімії для 7 класу (теми вказані в презентації).










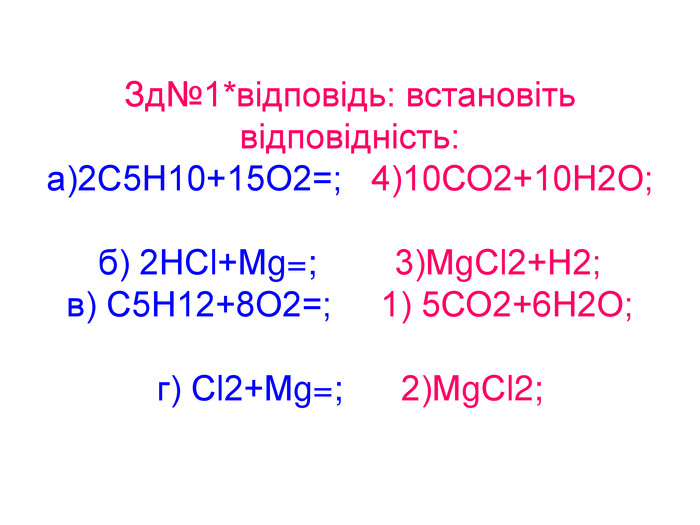


















































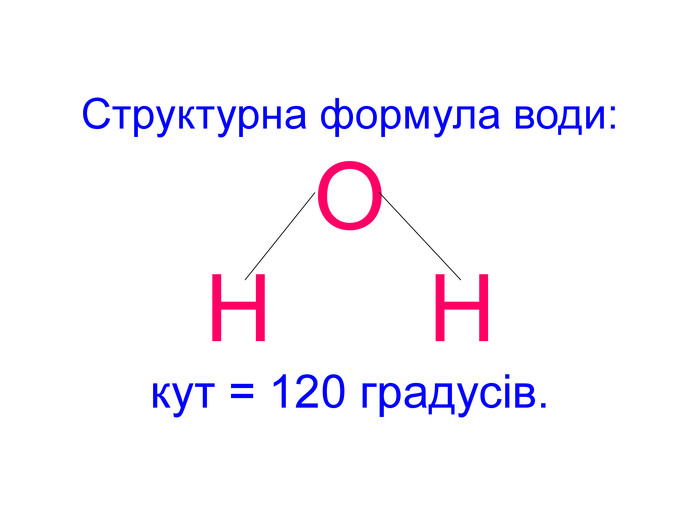
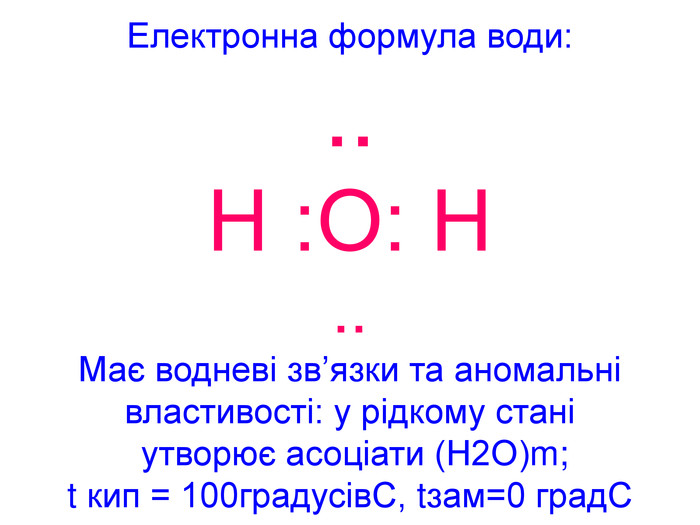

















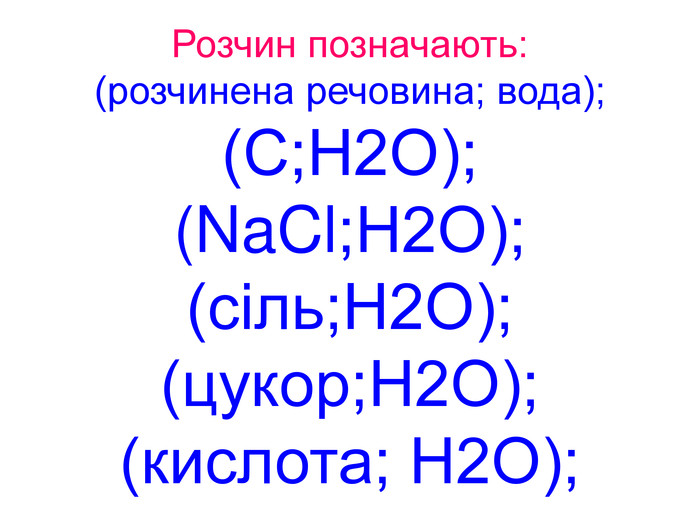








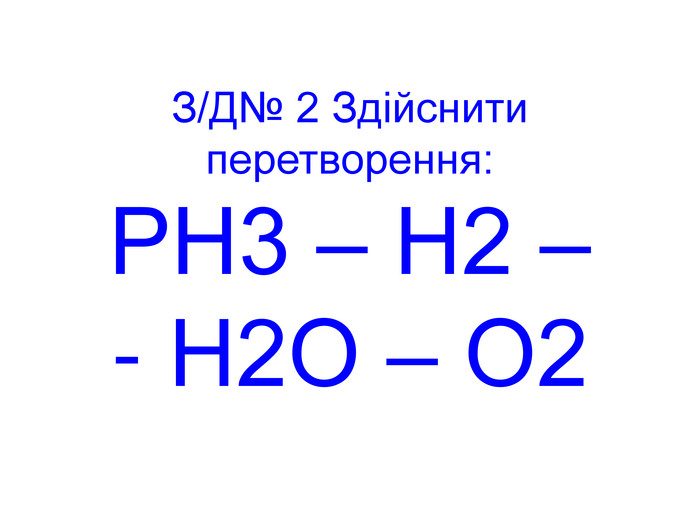




















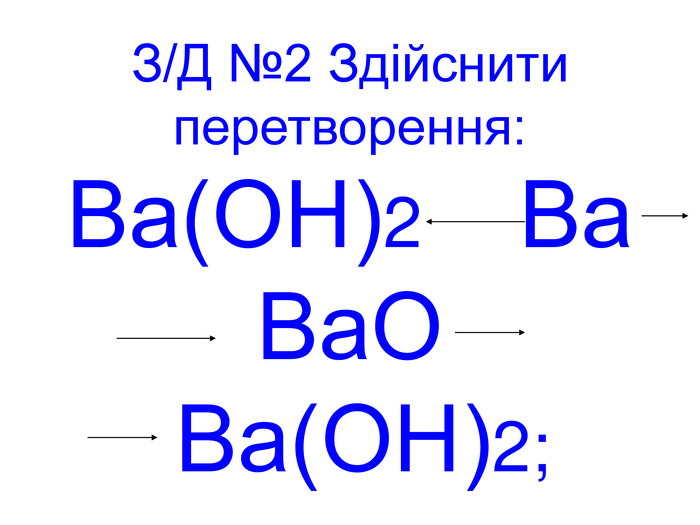





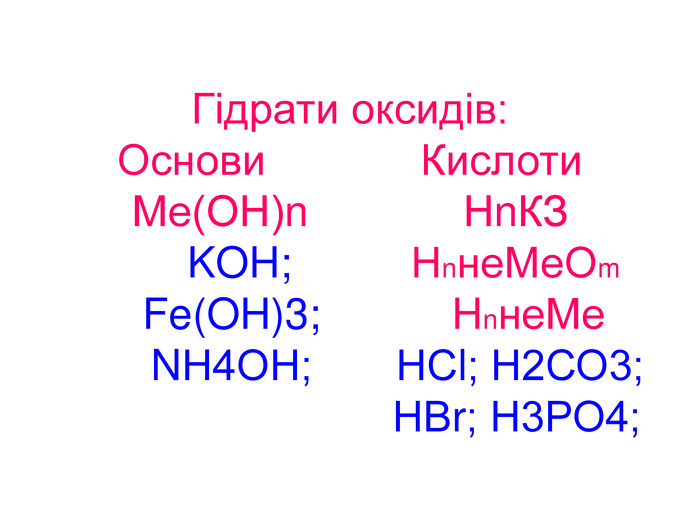































Вода – важливий складник усього живого. Вона є у всіх живих рослинних і тваринних істотах. Масові частки води в організмах приблизно такі: у риб-75%, у медузах-99%, у картоплі-76%, в яблуках -85%, у помідорах-90%, в огірках-95%, у кавунах -96%. В організмі людини залежно від віку – 50 – 86%(немовлята) води.
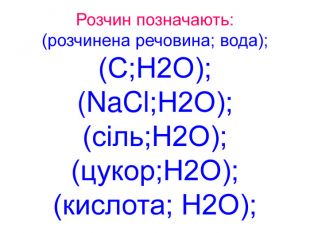
Виготовлення розчинів: 1. розрахувати за формулами масу(рр) та об’єм води, які потрібно для приготування розчину; 2. зважити масу та виміряти необхідний об’єм води; 3. зсипати, злити та змішати воду та рр у одній посудині – отримуємо розчин з конкретною концентрацією та маовою часткою (рр)


про публікацію авторської розробки
Додати розробку