Презентація до уроку: "Амфотерні гідроксиди"
Про матеріал
У презентації подано поняття амфотерних гідроксидів, способи добування та хімічні властивості. Матеріал полегшить викладання теми на дистанційному навчанні.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку








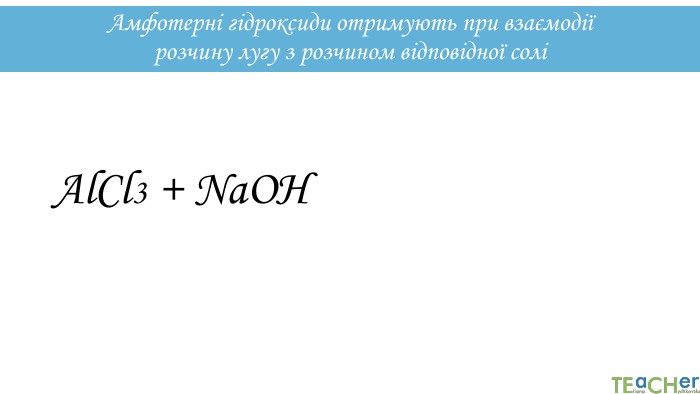





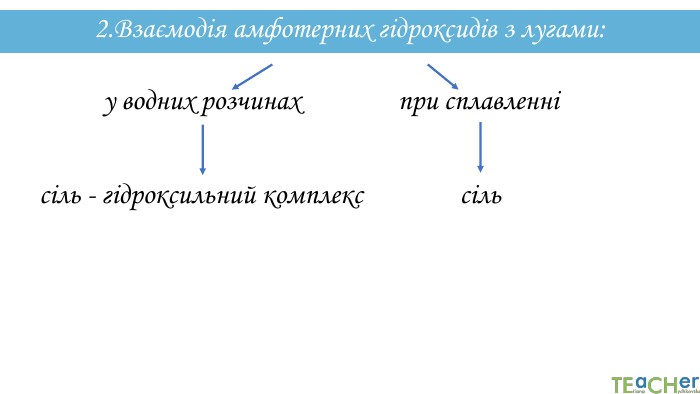

![2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6] 2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6]](/uploads/files/21504/291657/319163_images/16.jpg)
![2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6] 2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6]](/uploads/files/21504/291657/319163_images/17.jpg)
![2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6] 2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6]](/uploads/files/21504/291657/319163_images/18.jpg)
![2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6] 2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6]](/uploads/files/21504/291657/319163_images/19.jpg)
![2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6] 2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6]](/uploads/files/21504/291657/319163_images/20.jpg)
![2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6]натрій гексагідроксоалюмінат. Zn(OH)2 + 2 Na. OH = Na2[Zn(OH)4]натрій тетрагідроксоцинкат 2. Взаємодія амфотерних гідроксидів з лугами: Al(OH)3 + 3 Na. OH = Na3[Al(OH)6]натрій гексагідроксоалюмінат. Zn(OH)2 + 2 Na. OH = Na2[Zn(OH)4]натрій тетрагідроксоцинкат](/uploads/files/21504/291657/319163_images/21.jpg)






























-

Шатовський Валентин Олександрович
12.03.2025 в 18:44
Супер! Дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Чучина Тетяна
18.05.2023 в 11:18
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Полякова Євгенія Миколаївна
05.04.2023 в 20:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Хворостяна Вікторія Василівна
16.05.2022 в 20:06
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пашаєва Тетяна Миколаївна
02.05.2022 в 22:39
Дуже дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Логвин Ольга Володимирівна
02.05.2022 в 19:15
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука