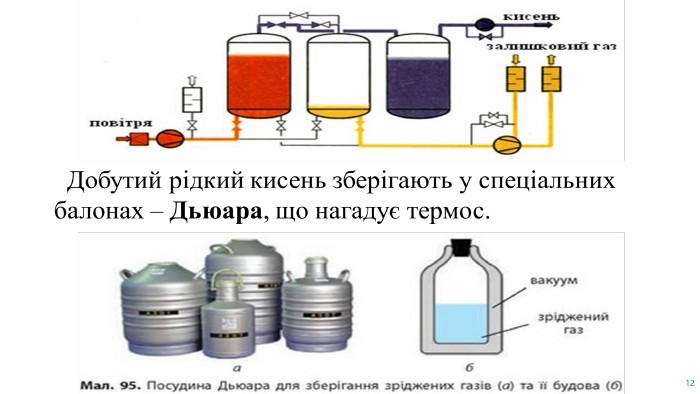
Презентація до уроку "Добування кисню в лабораторії та промисловості"
Про матеріал
Презентація до уроку "Добування кисню в лабораторії. Реакція розкладу. Поняття про каталізатор."
Мета уроку:
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку