Презентація до уроку: "Електролітична дисоціація кислот, основ, солей у водних розчинах"
Про матеріал
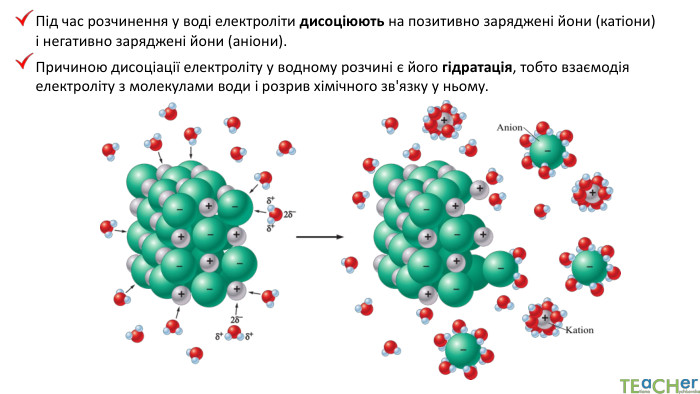
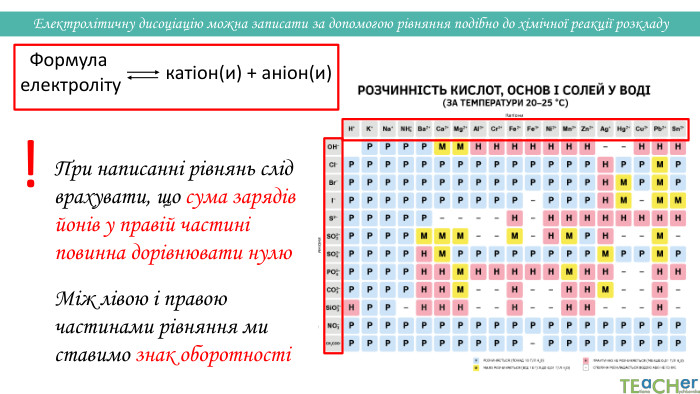
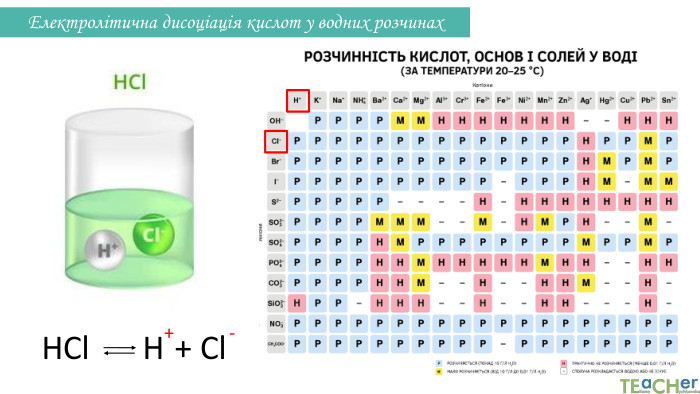
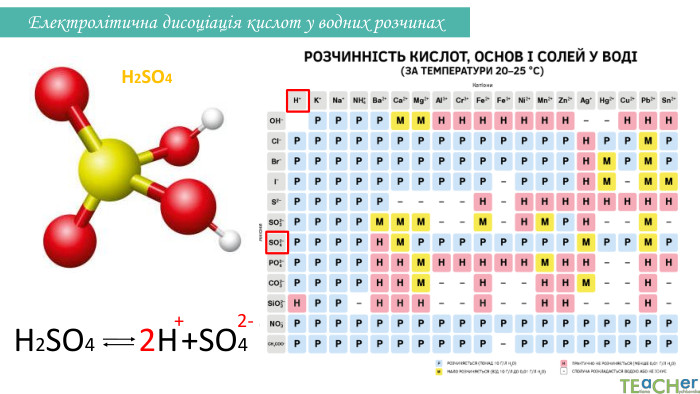
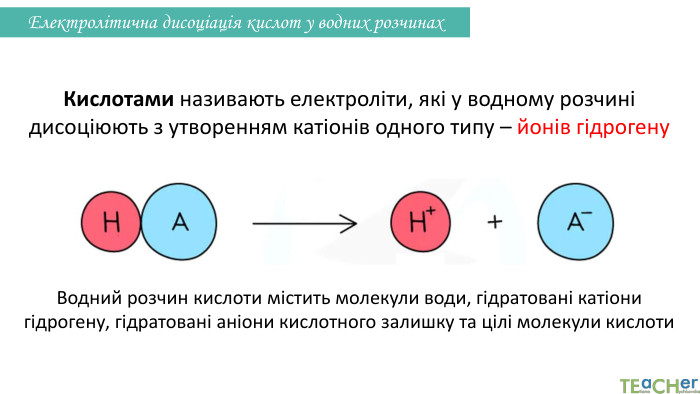
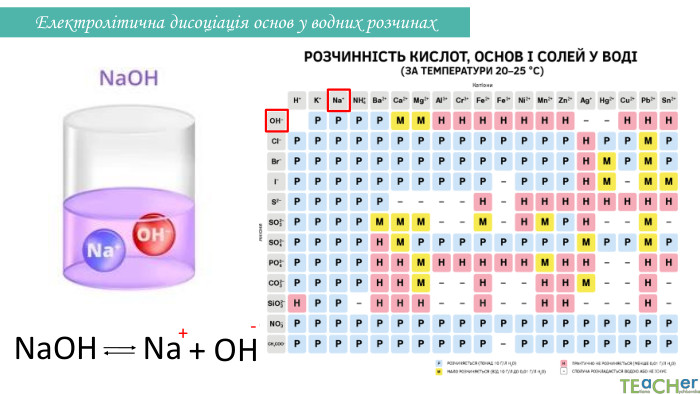
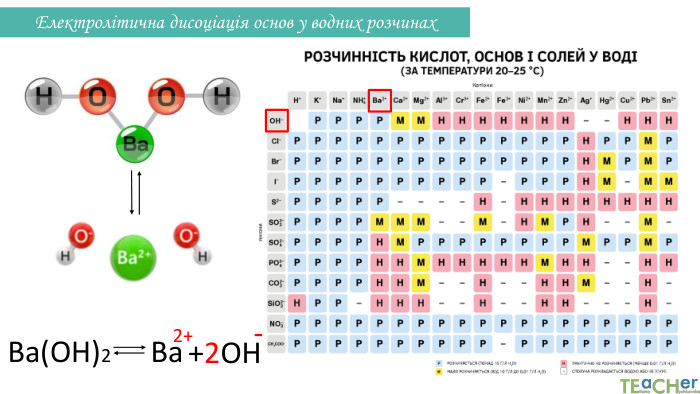
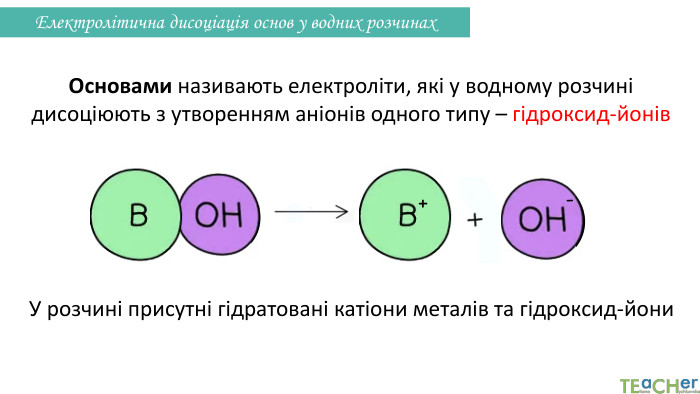
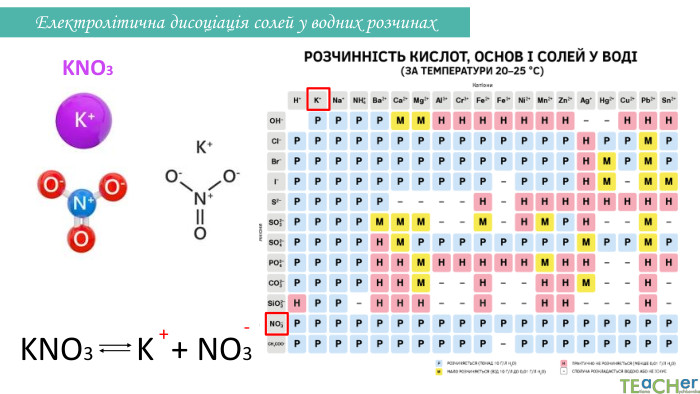
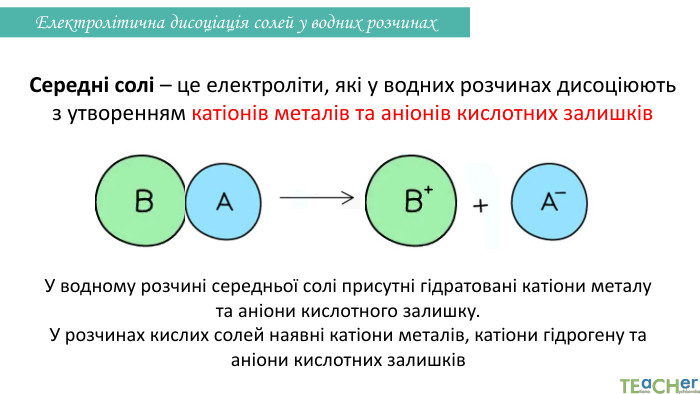
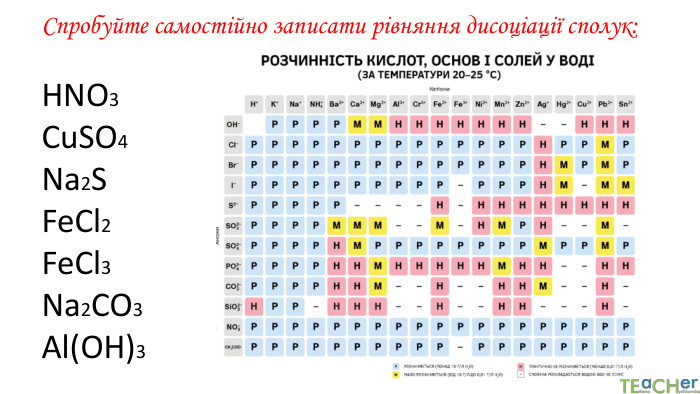
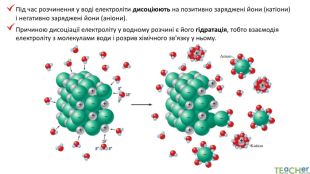
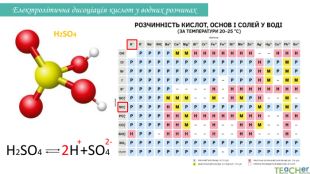
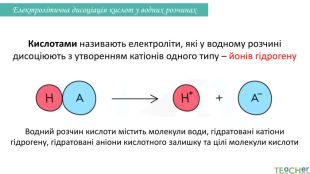
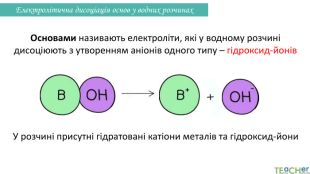
У презентації представлено матеріал про написання реакцій розпаду на йони таких електролітів, як кислоти, основи, солі. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
ДУЖЕ ДЯКУЮ. МАТЕРІАЛ ПОДАНО ПОСЛІДОВНО, НАУКОВО, ЦІКАВО
-
Щиро дякую!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку