Презентація до уроку: "Сильні й слабкі електроліти. Ступінь електролітичної дисоціації"
Про матеріал
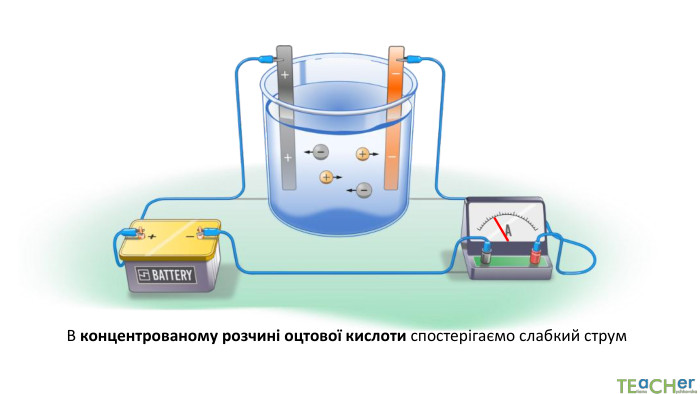
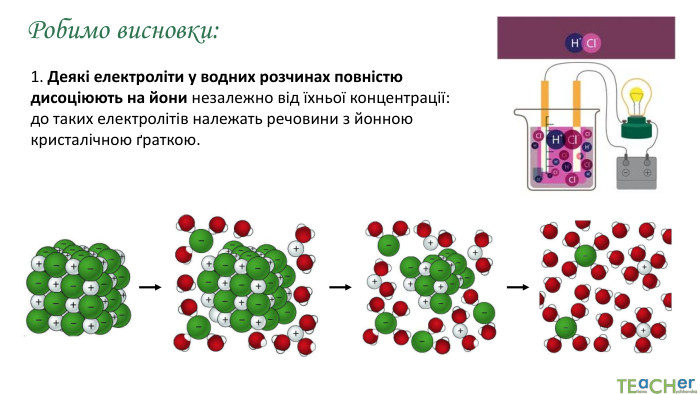
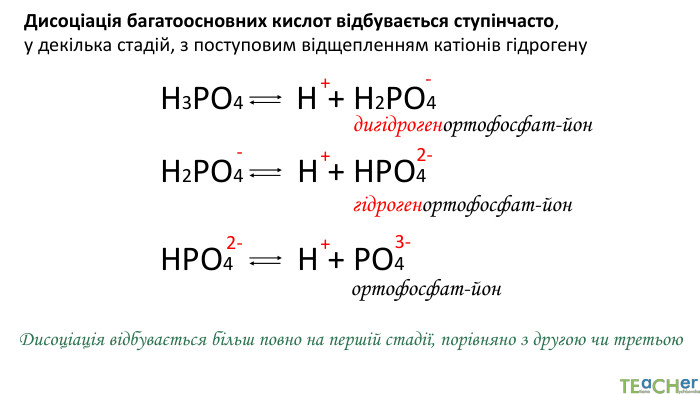
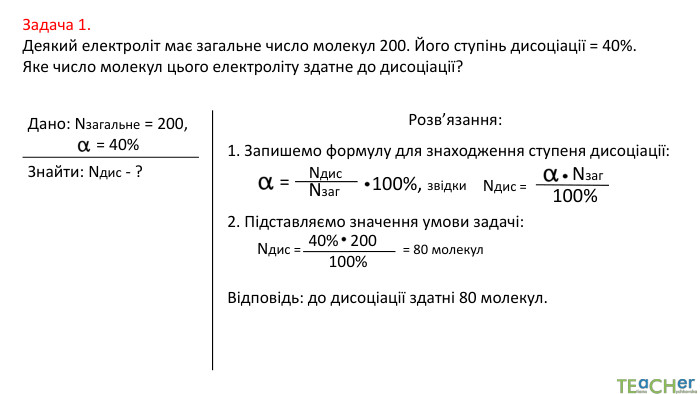
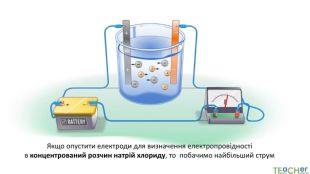
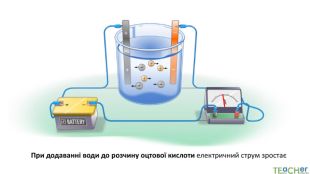
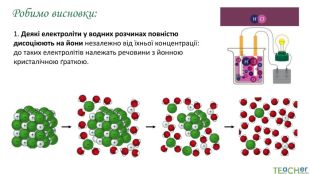
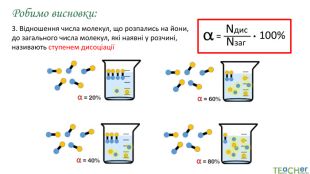
У презентації представлено матеріал про сильні, слабкі та електроліти середньої сили, ступінь електролітичної дисоціації, розглянуто приклади задач. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую дуже!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку