Презентація до уроку "Фізичні та хімічні властивості середніх солей"

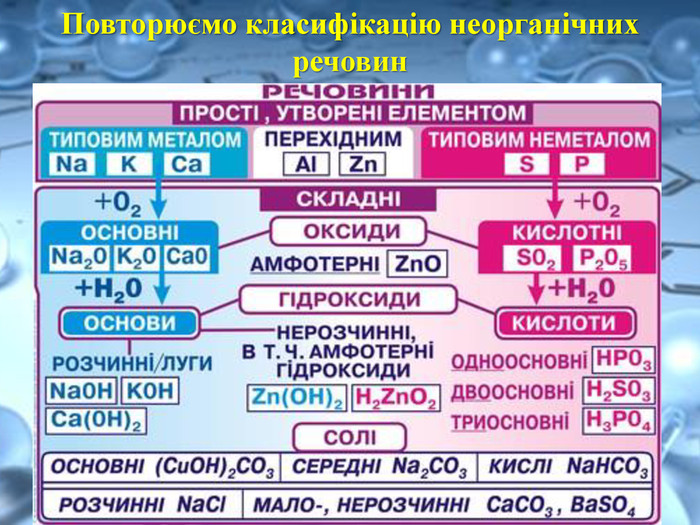
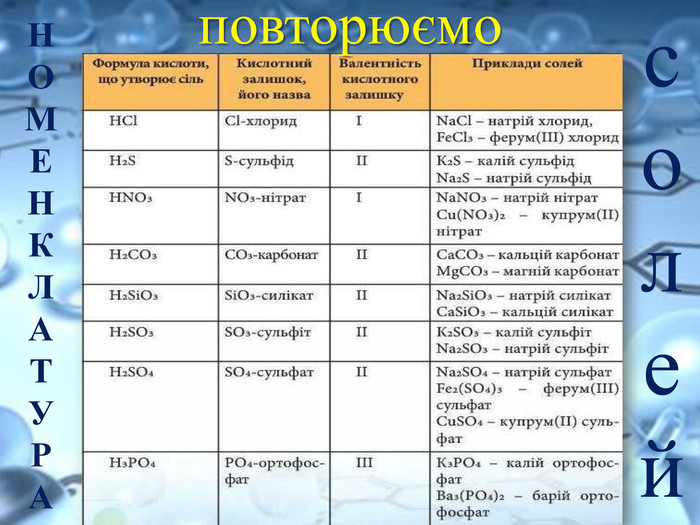
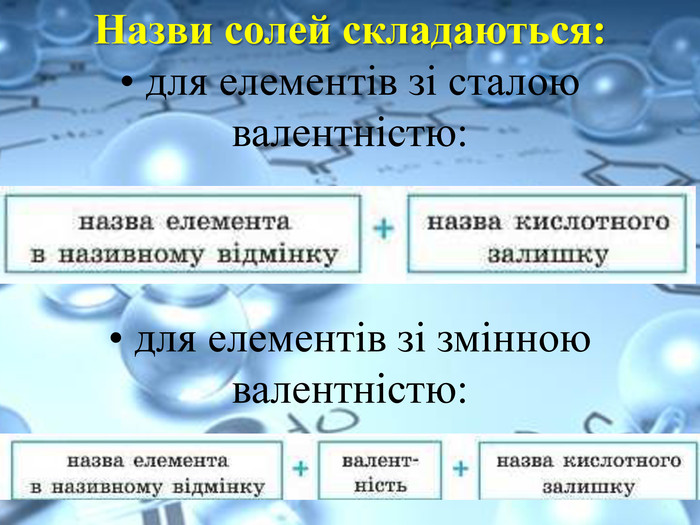



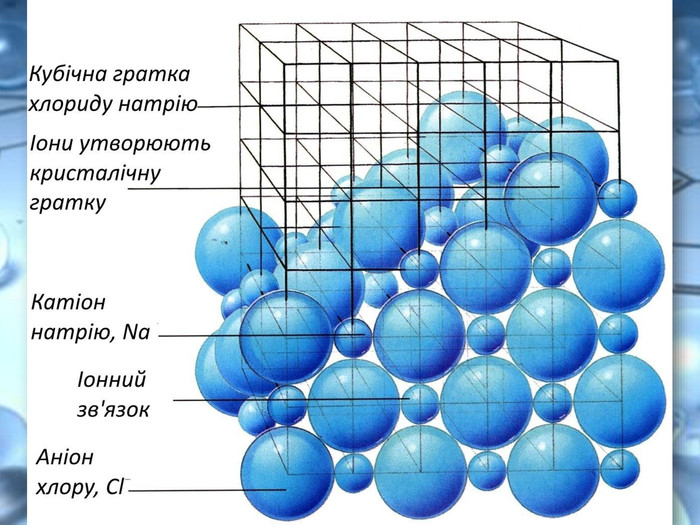















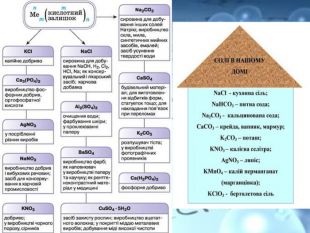
Солі переважно безбарвні, або, як кажуть, білі (хлориди та сульфати Калію, Натрію,Магнію, Цинку й інші) Деякі можуть бути забарвлені в різні кольори та відтінки: купрум(ІІ) сульфід Cu. S — чорний; нікель(ІІ) сульфат Ni. SO4 — зелений; кобальт(ІІ) сульфат Co. SO4 — рожевий.https://www.youtube.com/watch?v=h730 Ojt. S-LA Подивитись зразки солей за посиланням
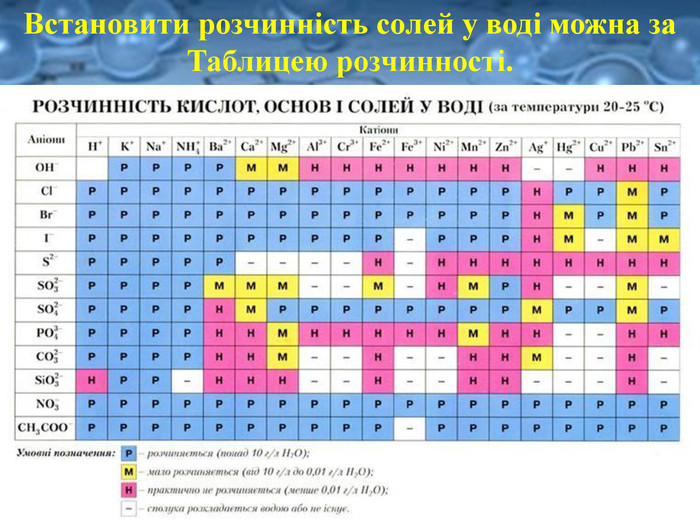
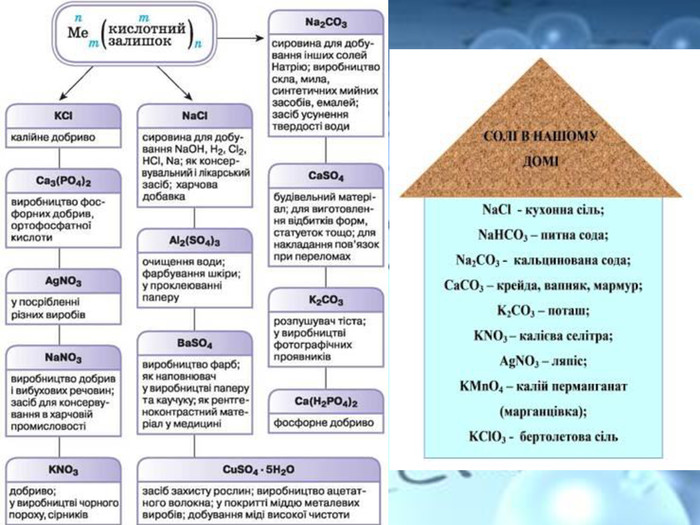
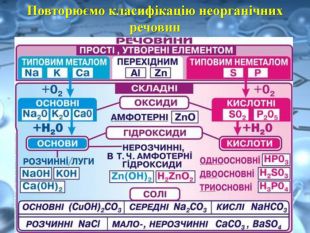
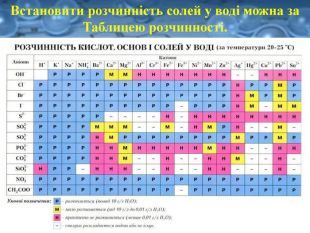
Розчинність є важливою характеристикою солей. Є солі розчинні (усі солі Натрію та Калію, а також усі нітрати ), малорозчинні та практично нерозчинні у воді. Серед силікатів, карбонатів, сульфітів, фосфатів і суль-фідів переважна більшість солей — нерозчинні у воді, наприклад: Fe. Si. O3, Cr. PO4.
Смак не є фізичною властивістю, і кожен знає, що речовини на смак у лабораторії пробувати не можна. Відомо, що алхіміки, досліджуючи властивості речовин, випробували їх на смак. Інколи це закінчувалось трагічно. Все ж встановлено, що серед солей солоний смак мають лише кухонна сіль, калій хлорид і натрій сульфат, інші — гіркі або змішаних смаків. Солодкими на смак є солі Берилію та Плюмбуму, але ці солі отруйні.
Взаємодія розчинів солей із металами. Працями М. Бекетова доведено, що метали проявляють різну хімічну активність. Тому в реакціях між металом і сіллю тільки активніший метал витіснить менш активний. Наприклад, якщо мідну монету покласти в розчин меркурій (II) нітрату, вона поступово покривається шаром ртуті, а мідь переходить в розчин:
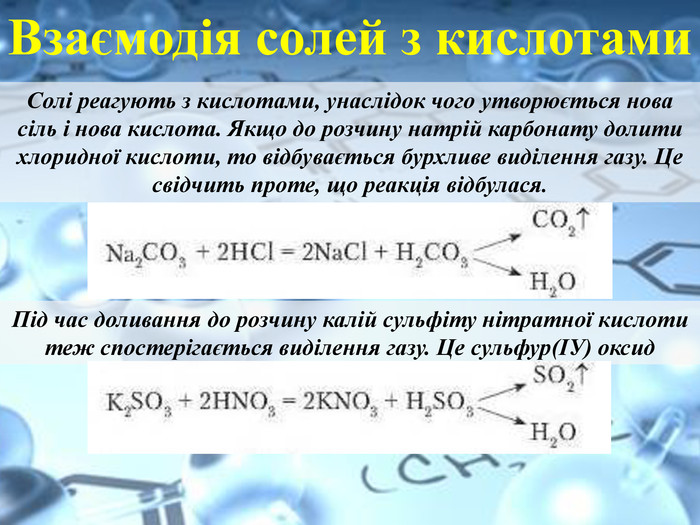
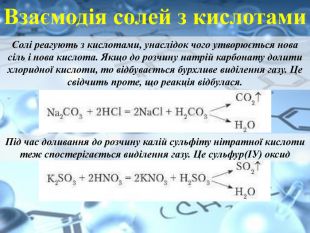
Взаємодія солей з кислотами. Солі реагують з кислотами, унаслідок чого утворюється нова сіль і нова кислота. Якщо до розчину натрій карбонату долити хлоридної кислоти, то відбувається бурхливе виділення газу. Це свідчить проте, що реакція відбулася. Під час доливання до розчину калій сульфіту нітратної кислоти теж спостерігається виділення газу. Це сульфур(ІУ) оксид
Візьмемо розчин барій хлориду й подіємо розчином сульфатної кислоти. Спостерігається випадання білого осаду. Ba. Cl2 + H2 SO4 =Ba. SO4 + 2 HCl. Вам уже відома реакція між аргентум нітратом і хлоридною кислотою. Під час цієї реакції випадає білий сирнистий осад. Ag. NO3 + HCl = Ag. Cl +HNO3 Отже, зробимо висновок про взаємодію розчинів солей з кислотами. Реакції між солями й кислотами в розчинах відбуваються за умови, якщо:1) утворюється нова сіль і нова кислота. Нова кислота є нестійкою та розкладається на відповідний їй оксид і воду. У результаті реакції виділяється газ;2) випадає нерозчинний у кислотах осад.
Взаємодія солей із лугами. Напишіть самостійно рівняння реакцій взаємодії цинк сульфату, плюмбум(ІІ) хлориду, ферум(ІІІ) нітрату з натрій гідроксидомhttps://www.youtube.com/watch?v=SXXti. KSSRp. M https://www.youtube.com/watch?v=ZIpv. K7 O49 Yo Віртуальні лабораторні досліди ВЗАЄМОДІЯ СОЛЕЙ З ЛУГАМИ
Взаємодія розчинів солей між собою. Розчинні у воді солі вступають у реакції обміну. Солі вступають у реакції обміну між собою тільки в розчинах. Подивіться лабораторний дослід «Взаємодія аргентум(І) нітрату з натрій ортофосфатом» і напишіть рівняння реакціїhttps://www.youtube.com/watch?v=1 WBA_M1 ORr0&feature=emb_logo
https://learningapps.org/display?v=phqsjm1ra17 ПІДСУМОВУЄМО ВИВЧЕНЕ• Розчини солей взаємодіють з металами, якщо метал, що входить до складу солі, менш хімічно активний.• Розчини солей реагують з кислотами. Реакції між солями й кислотами в розчинах відбуваються за таких умов:1) виділяється газ:2) випадає осад;3) утворюється вода.• Під час взаємодії розчинів солей з лугами утворюється нова сіль і нова основа.• Розчини солей взаємодіють між собою. Реакції відбуваються до кінця, якщо один із продуктів реакції випадає в осад. Аргєнтум(І) нітрат є реактивом на хлоридну кислоту та її солі, а барій хлорид є реактивом на сульфатну кислоту та її солі. Виконуємо інтерактивну вправу:


про публікацію авторської розробки
Додати розробку




















-

Колесник Наталія Іванівна
10.04.2023 в 23:03
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
04.04.2022 в 09:47
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гуменюк Олена
15.03.2022 в 22:17
Дякую за гарну роботу,натхнення у подальшій діяльності
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Душейко Галина
14.04.2021 в 23:10
дякую, дуже гарна робота
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Зубчик Віта Олександрівна
11.04.2021 в 14:48
Дякую за презентацію)
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Нехаєнко Юлія Валеріївна
16.04.2020 в 15:57
Дякую за чудову презентацію.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука