Презентація до уроку фізики і хімії у побуті на тему"Благородні метали: золото, платина, срібло. Властивості цих металів. Використання в народному господарстві."
Про матеріал
Презентація до уроку фізики та хімії у побуті у 7 класі за індивідуальною формою навчання на тему "Благородні метали: золото, платина, срібло. Властивості цих металів. Використання в народному господарстві" , відповідно навчальній програмі для 5-9 (10) класів спеціальних загальноосвітніх навчальних закладів для розумово відсталих дітей
"ФІЗИКА І ХІМІЯ У ПОБУТІ" 8-10 класи( Укладачі: Татьянчикова І.В.,
Співак Л.А.) Перегляд файлу
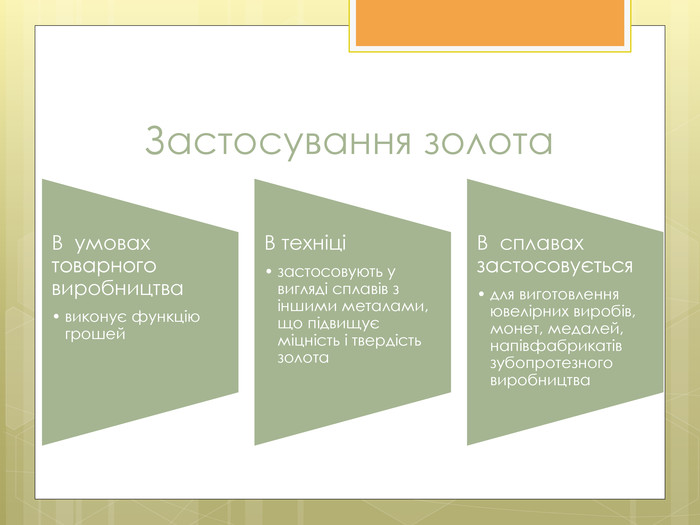
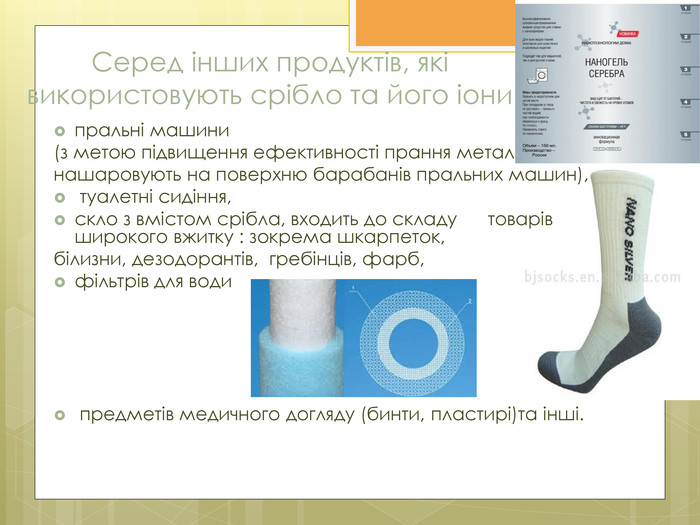
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку