Презентація до уроку хімії 8 класу "Закон Авогадро. Молярний об'єм газів. Розрахунки за хімічними формулами"
Про матеріал
Презентація до уроку хімії 8 класу "Закон Авогадро. Молярний об'єм газів. Розрахунки за хімічними формулами" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
презентація - супер!!!
-
-
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




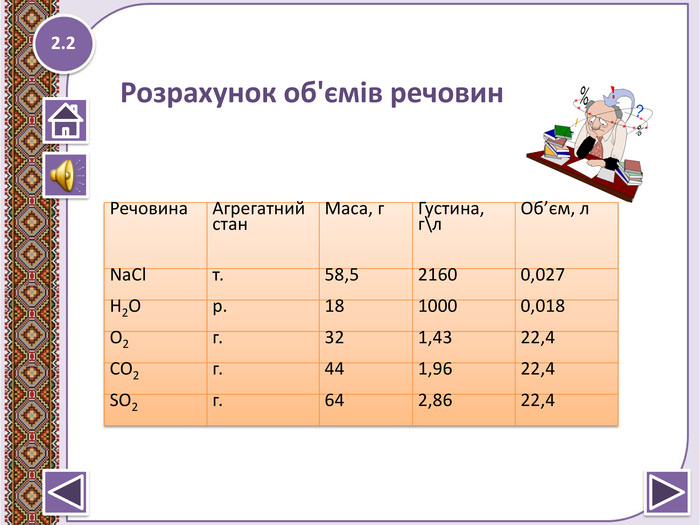
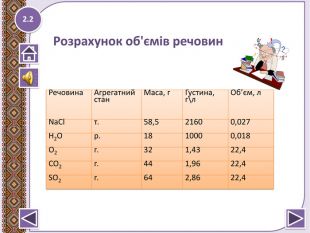
![Молярний об'єм 2.2 Vm = = 22,4 л\моль; [Vm] = л\моль. Vm = = = = 22,4 л\моль. Молярний об'єм ідеального газу (за нормальних умов (273,15 К, 101325 Па) Vm = 22,41383(70)·10−3 м3/моль. У практичному використанні зручнішими одиницями є дециметри кубічні (літри) на моль (дм3/моль) для газів та сантиметри кубічні на моль для рідин та твердих тіл (см3/моль). Молярний об'єм 2.2 Vm = = 22,4 л\моль; [Vm] = л\моль. Vm = = = = 22,4 л\моль. Молярний об'єм ідеального газу (за нормальних умов (273,15 К, 101325 Па) Vm = 22,41383(70)·10−3 м3/моль. У практичному використанні зручнішими одиницями є дециметри кубічні (літри) на моль (дм3/моль) для газів та сантиметри кубічні на моль для рідин та твердих тіл (см3/моль).](/uploads/files/377911/106808/113654_images/6.jpg)