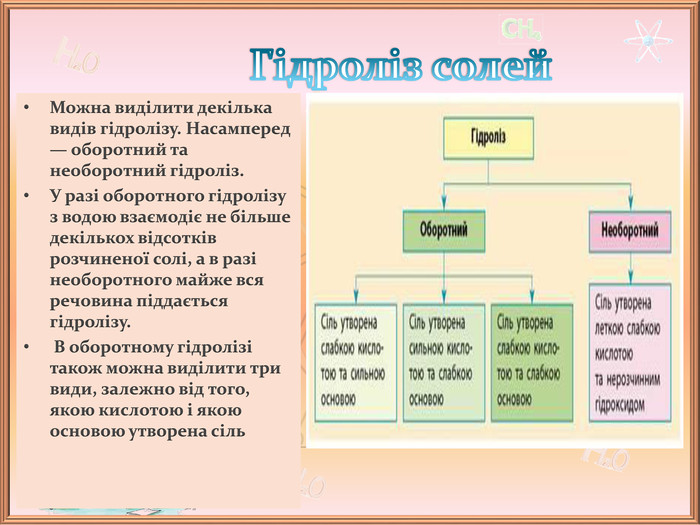
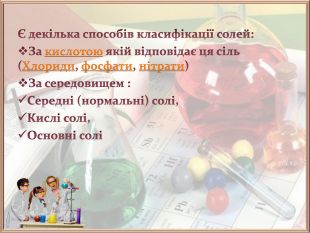
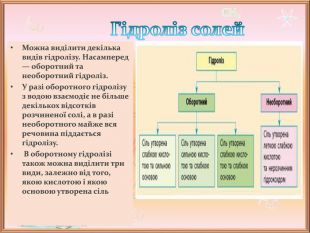
Презентація до уроку хімії на тему "Гідроліз солей"
Про матеріал
Презентація до уроку хімії на тему "Гідроліз солей"
Даний матеріал можна використовувати на уроках хімії . Перегляд файлу
Зміст слайдів

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку