Презентація до уроку хімії у 7 класі "Застосування та біологічна роль кисню"
















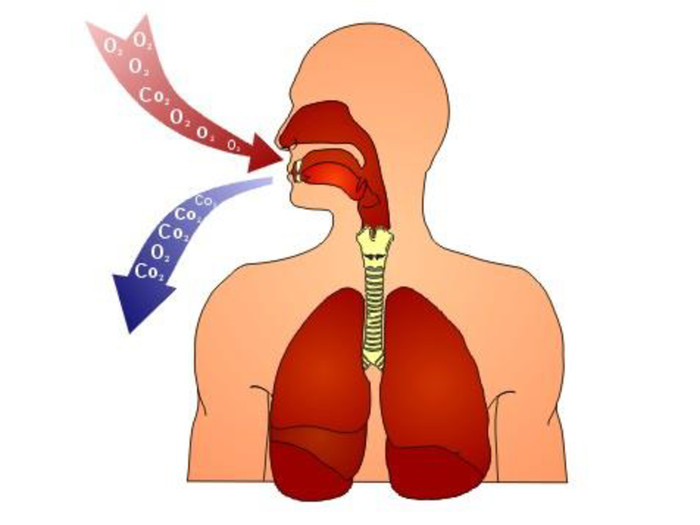























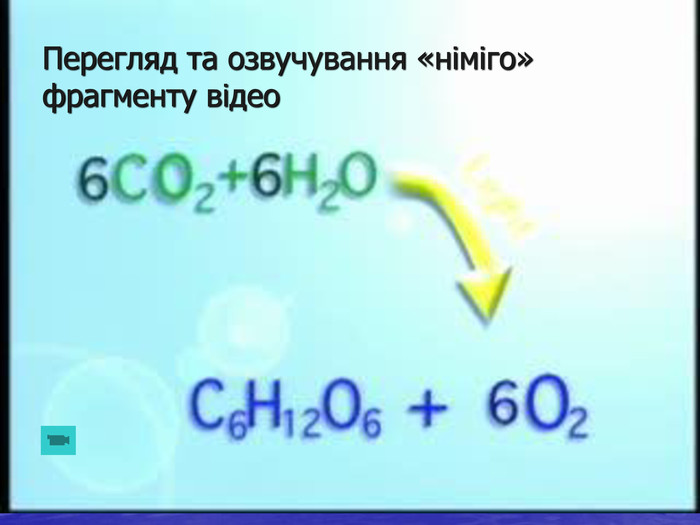




Бліц-опитування «Один з трьох» По кисень, озон чи Оксиген йде мова? 1. Є складовою частиною повітря... 2. Молекула складається з двох атомів Оксигену... 3. Риби дихають розчиненим у воді ... 4. Входить до складу води… 5. Утворює шар в атмосфері, який захищає все живе від надмірного ультрафіолетового випромінювання.. 6. Твердий – кристали блакитного кольору... 7. Молекула складається з трьох атомів Оксигену... 8. Одержують з рідкого повітря... 9. Входить до складу багатьох мінералів... 10. В лабораторії одержують шляхом розкладу Гідроген пероксиду...
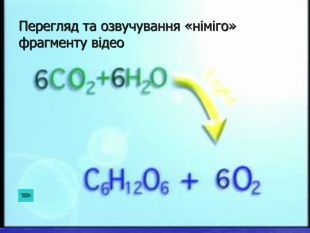
РоРрозставте Розставте коефіцієнти у схемах хімічних реакцій Процеси, які відбуваються під час горіння сірника: Розклад Калій хлорату (бертолетової солі) КСIO3 = КСI + O2 Горіння Стибій (ІІІ) сульфіду Sb2S3+ О2 = SО2 + Sb2O3 Горіння фосфору Р + О2 = Р2О5 __________________________________________________________________ Горіння метану СН4+ О2= СО2+ Н2О Горіння магнію Мg + О2 = МgО Горіння ацетилену С2 Н2 + О2 = СО2 + Н2О Горіння бензину С8 Н18 + О2 = СО2 + Н2О Горіння парафіну С14 Н30 + О2 = СО2 + Н2О Горіння деревини (С6 Н10О5)n + nО2 = nСО2 + nН2О
Памятка «Дихайте на здоров’я» Дихати правильно треба вміти, щоб організм у здоров’ї міг жити, упевнені й сильні були ваші кроки, щоб ви активні були на уроках. Дихайте радісно, вільно у лісі, чи біля річки, чи на узліссі, там, де дерева ростуть й плодоносять, і з фотосинтезу кисень приносять. За чистотою повітря слідкуйте, гемоглобін у крові контролюйте. Будьте подалі від всякого диму, спортом активним займайтесь щоднини. Плавайте, можете ще й веслувати, щоби об’єм легень розширяти. Не забувайте свою діафрагму – кращим зробити процес вона прагне. Тим, хто ще палить, не співчувайте, краще їх фактами так налякайте, щоб в них цигарка випала з рота й враз остогидла аж до блювоти!
Дихальна фізкультхвилинка (декілька разів глибоко вдихнути та видихнути) Робота в групах Випереджувальне завдання Опрацювання інформації та презентація повідомлень за темами: «Цікаві факти про кисень» «Звідки кисень в атмосфері» «Кисень та науково-технічний прогрес» «Кисень у медицині та біології» «Оксиген в оболонках Землі»
Цікаві факти про кисень - Рідкий кисень, як і залізо, притягується до магніту. - Тривалість одного циклу кругообігу Оксигену – 2 тисячі років. - Людство за рік використовує понад 1 мілліарду м3 кисню. - Організм дорослого чоловіка щодоби споживає приблизно 900 г кисню, жінки – 600 г. - Середньостатистичне добове споживання кисню людиною – 4 м3 - Легковий автомобіль на 1500 км пробігу використовує річну норму кисню, необхідну людині. - За добу людина вдихає приблизно 25 кг повітря (в перерахунку на кисень – приблизно 5 кг). - Через легені за добу в середньому проходить 800 літрів кисню.
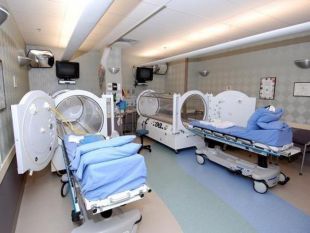
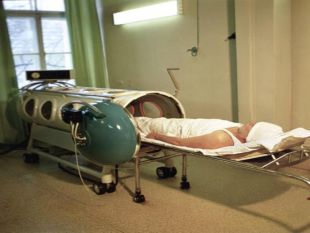
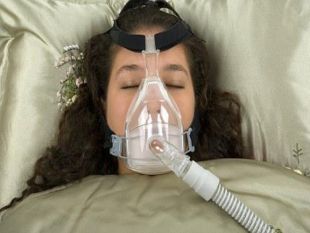
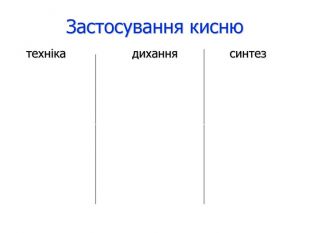
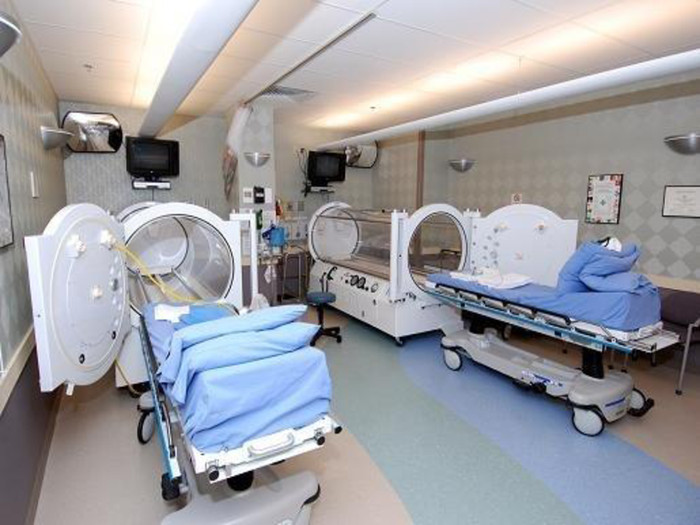
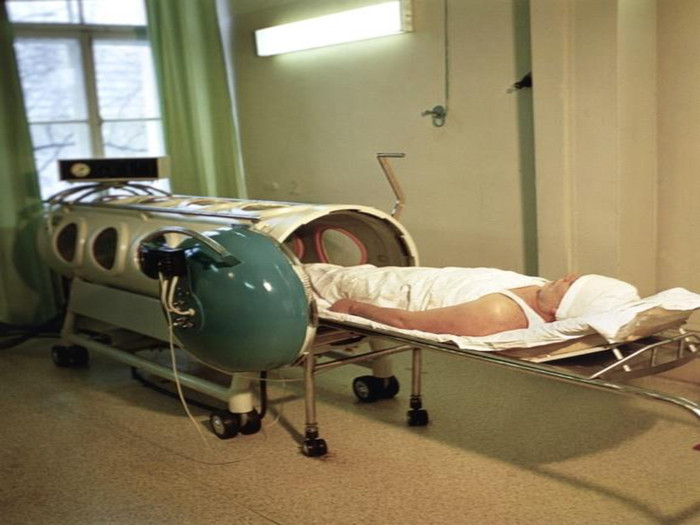
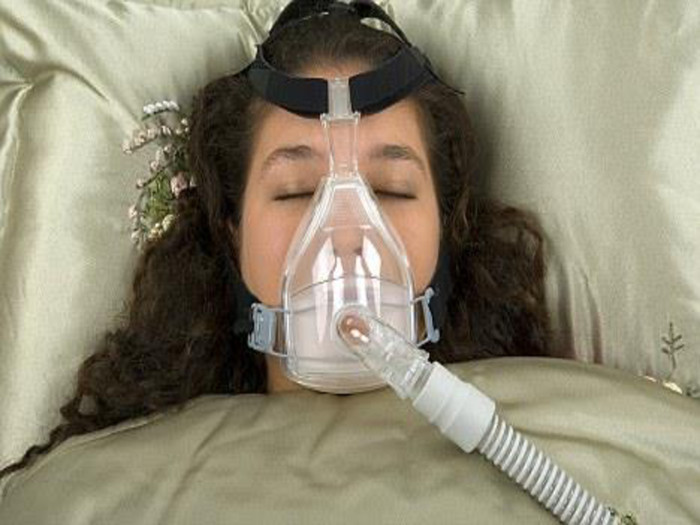
Кисень у медицині У медицині з’явився новий спосіб лікування – киснетерапія (лікування киснем). Він заснований на різкому насиченні організму киснем під дією підвищеного тиску. У барокамері можна з успіхом робити операції на головному мозку, серці, лікувати захворювання, пов’язані з кисневою нестачею: бронхіальна астма, інфаркт міокарда, інсульт. Однак зловживання киснетерапією може привести до отруєння з такими симптомами: сильна втома, важкість у всьому тілі, слабкість та сонливість. Лікарі рекомендують 10-15 хв дихальної киснетерапії на день. Заряд бадьорості та ясності мислення гарантований. Корисний і кисневий коктейль, особливо для спортсменів під час посилених тренувань, бо великі об’єми кисню ідуть на забезпечення роботи м’язів і вони відчувають кисневе голодування (гіпоксію). Останнім часом з’явилася і киснева косметика, яка сприяє підвищенню енергійності клітин шкіри, активізує їх поділ і відновлення. В аптеках кисень зберігають у балонах об’ємом 27-50 л, які містять 4-7,5 м3 газу під тиском 10 – 15 МПа. Балони забарвлені в синій колір. Різьбу балону посипають тальком (ні в якому разі не можна змазувати жиром чи органічними мастилами, щоб не було спалаху від струменю кисню).
Кисень та науково-технічний прогрес Кисень використовується як окисник палива в ракетних двигунах, під час вибухових робіт, для одержання кислот, оксидів, для зварювання та різання металів, у металургійних виробництвах. Альтернативою мартенівському способу виробництва сталі є киснево-конверторний. Його перевага – відсутність використання природного газу й добра керованість технологічним процесом. Кисень застосовують у приладах та пристріях для роботи у важкій для дихання атмосфері. Його можна використовувати навіть для руйнування грозових хмар. Змішуючись у спеціальному генераторі, кисень з ацетиленом загоряється електричною іскрою. Під час вибуху в атмосфері виникає ударна хвиля, що діє на хмару й замість граду йде дощ.
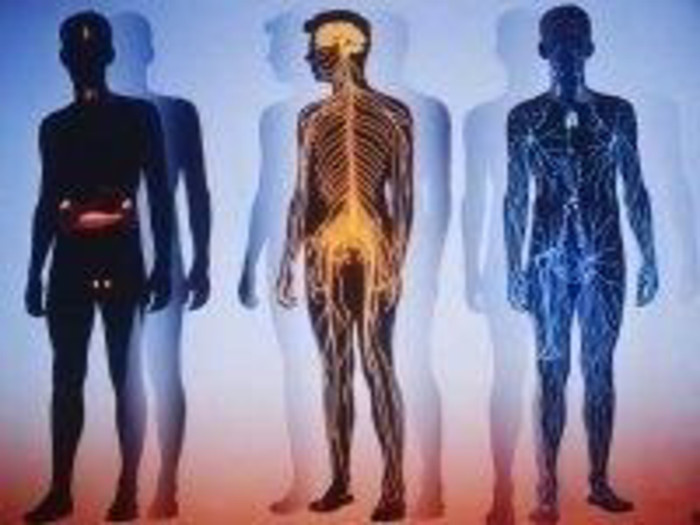
Оксиген в оболонках Землі Оксиген – найпоширеніший у земній корі елемент, його вміст становить близько 47% її маси. Він утворює понад 1400 мінералів. Пісок містить 53% Оксигену, глина – 56%. У складі морської води - 89%. У всіх природних водах кисень міститься і у вільному стані. Біохімічне самоочищення річкової та морської води відбувається з використанням розчиненого у воді кисню. Оксиген входить до складу таких біологічно важливих речовин як білки, жири, вуглеводи, нуклеїнові кислоти, складає до 50-85% ваги тваринних і рослинних тканин. В організмі людини 65% Оксигену.
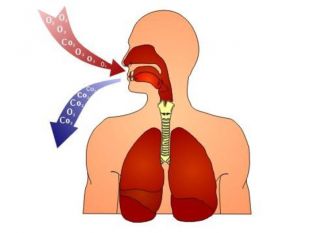
Кисень в атмосфері У повітрі 23% кисню з масою, 21% - за об’ємом. Якщо б сталося незвичайне й кількість кисню в атмосфері збільшилась до 30 % за об’ємом (від 21 % , як зараз), перша блискавка спалила б усе на Землі: навіть сира деревина горіла б як порох, усі процеси в живих організмах прискорилися б і вони почали швидше старішати. А що б відбувалося, якби кількість кисню в атмосфері поступово зменшувалася? Якщо зменшити вміст кисню у повітрі: до 17% - згасне масляна лампа шахтаря; до 14% - згасне свічка; до 13,5% - згасне сірка, що горить; до 12% - згасне полум’я ацетилену, дихання стане більш глибоким; до 11% - згасне полум’я спиртівки; до 10% - людина почне трохи задихатися; до 6% - згасне водневе полум’я; до 5% - людина почне задихатися, настане запаморочення, з часом – смерть; до 2% - втрата свідомості через 1 хвилину і смерть.
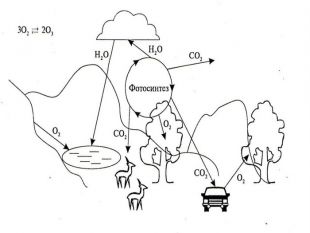
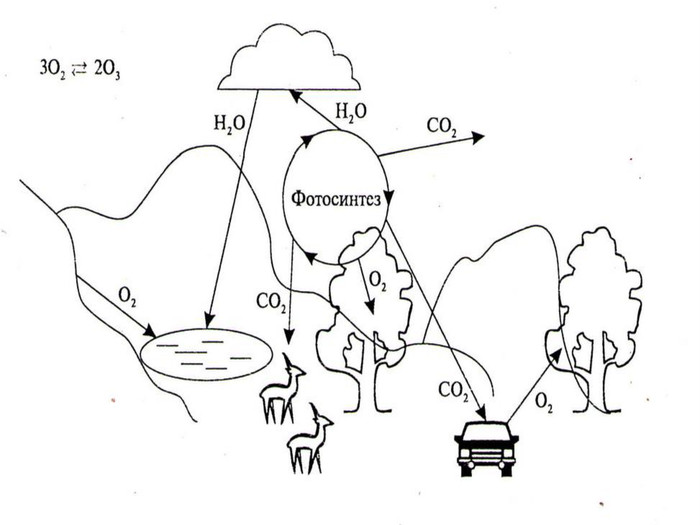
Звідки кисень в атмосфері Землі? Близько 4 млрд років тому кисню в атмосфері Землі не було, а були інші гази: водень, вуглекислий газ, амоніак, метан, водяні пари. Поява 2,5 млрд років тому у воді океанів синьо-зелених водоростей стала початком появи кисню в атмосфері. Ці водорості засвоювали Гідроген з води, Карбон з розчиненого у воді вуглекислого газу, виділяючи кисень. Через 20000 років уміст кисню досяг сучасного рівня (21% за об’ємом), або 1015 т. Населенню Землі та тваринам треба дві тисячі років, щоб витратити весь кисень, а рослинам і водоростям достатньо 600 років, щоб відновити масу кисню в атмосфері. Найактивнішими „виробниками” кисню є не рослини, а дрібні водорості, що ростуть у теплих шарах морів і океанів. Підраховано, що рослини на суші виробляють кожного року 53 млрд т кисню, а водорості – майже в 10 разів більше.
Висновок: Елемент цей добре знають І просту речовину, Кисень всюди поважають За важливу роль. Яку? Він для дихання потрібен Всім навкруг – тобі й мені, Він – в рослинах і тваринах В мінералах і воді… Також є він санітаром, Бо не терпить він сміття. І рослинне, і тваринне Обумовлює гниття… Він зусиль не тратить марно, Все горить у ньому гарно… Цей дивовижний газ Творить життя для нас!
-
 Поливана Діана 03.03.2024 в 12:41Загальна:3.0Структурованість3.0Оригінальність викладу4.0Відповідність темі2.0
Поливана Діана 03.03.2024 в 12:41Загальна:3.0Структурованість3.0Оригінальність викладу4.0Відповідність темі2.0


про публікацію авторської розробки
Додати розробку