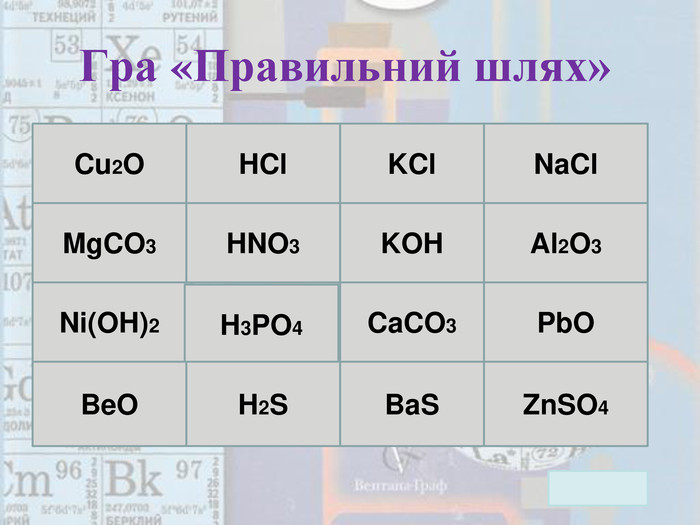
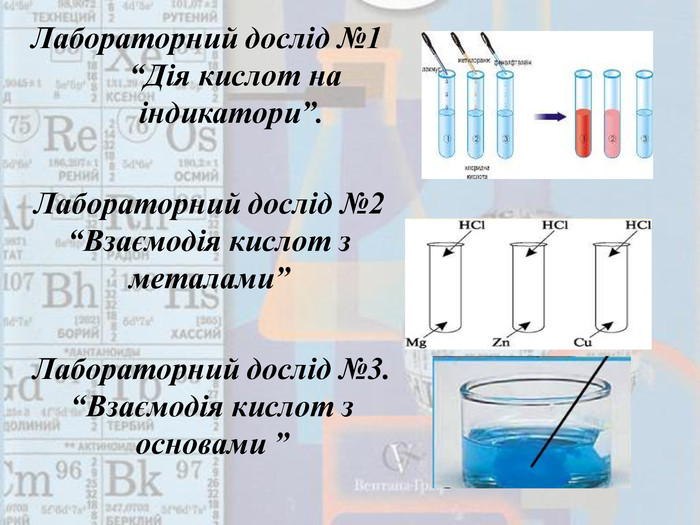
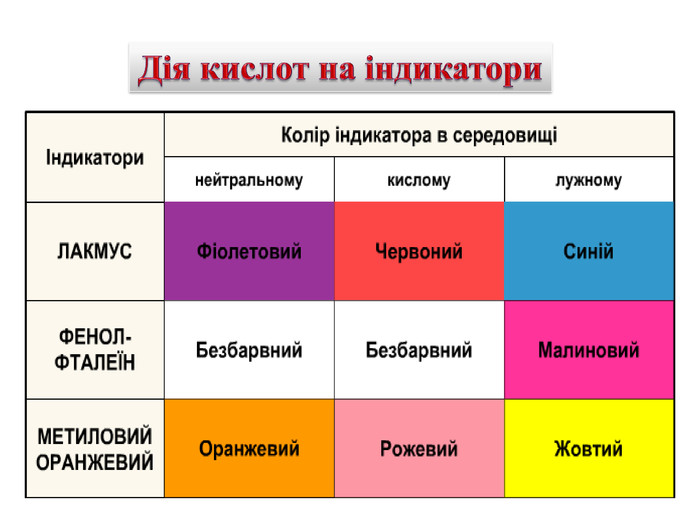
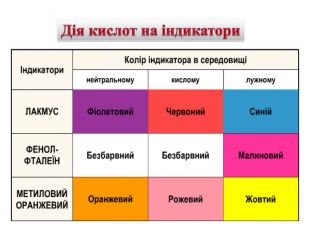
Презентація до уроку "Хімічні властивості кислот"
Про матеріал
Презентація розроблена як супровід уроку "Хімічні властивості кислот". У презентації використовуються посилання на сервіс LearningApps.org? тому для повного використання даної презентації на уроці необхідний доступ до інтернету. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку