Презентація до уроку "Хімічні властивості солей"
Про матеріал
Презентація містить теоретичний та практичний матеріал для засвоєння знань з наведеної теми Перегляд файлу
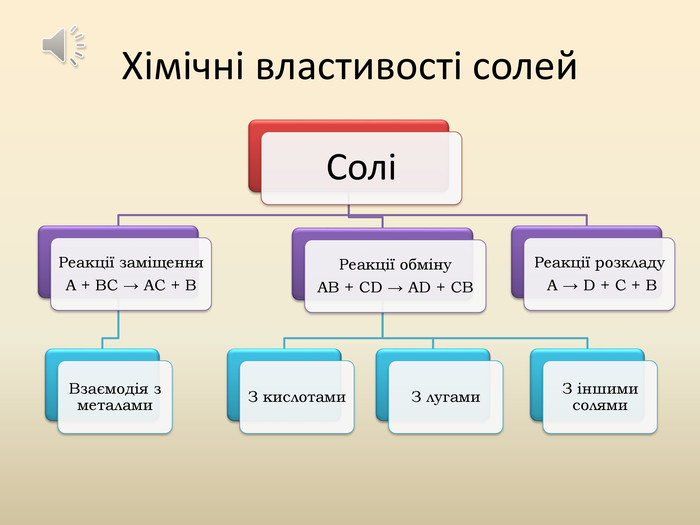
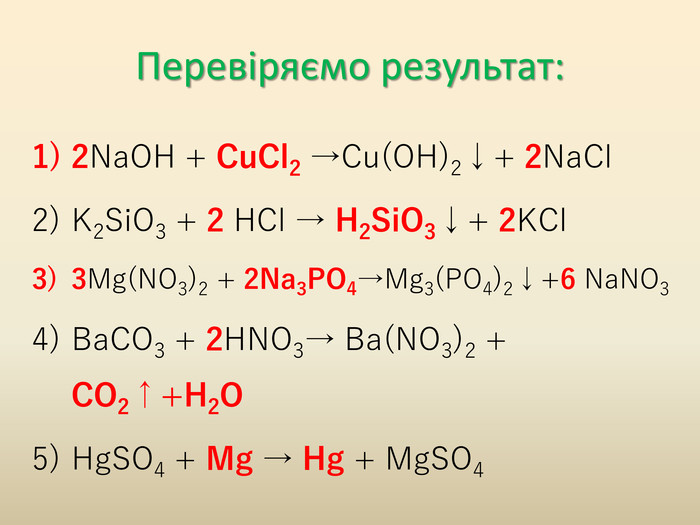
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку