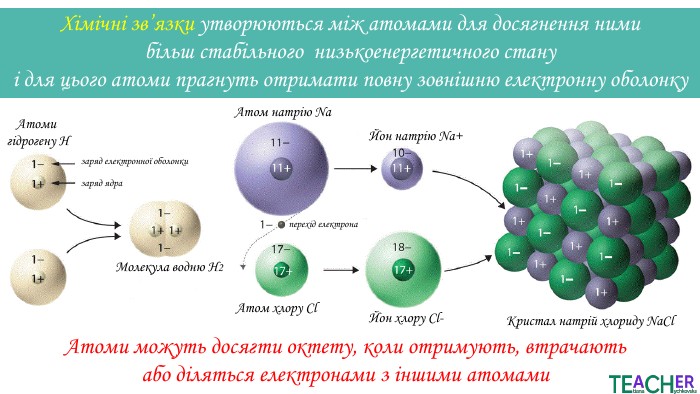
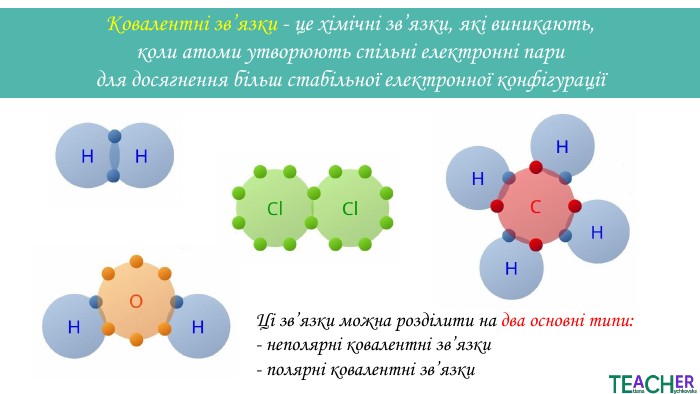
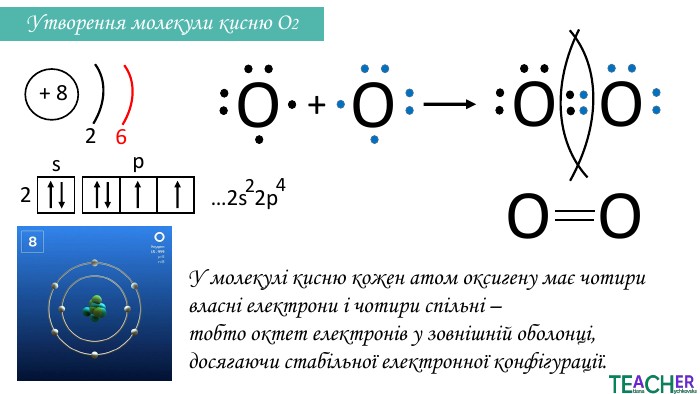
Презентація до уроку: "Ковалентний неполярний зв'язок"
Про матеріал
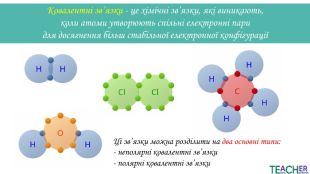
Слайди презентації полегшать викладання матеріалу вчителю про утворення ковалентного неполярного зв'язку, особливо на дистанційних уроках. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!
-
Щиро вдячна!

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку