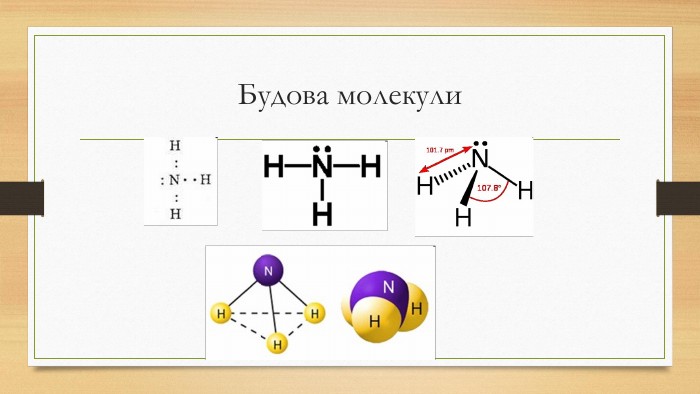
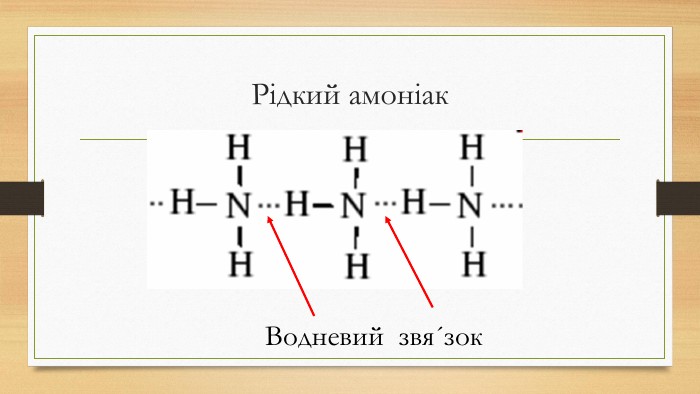
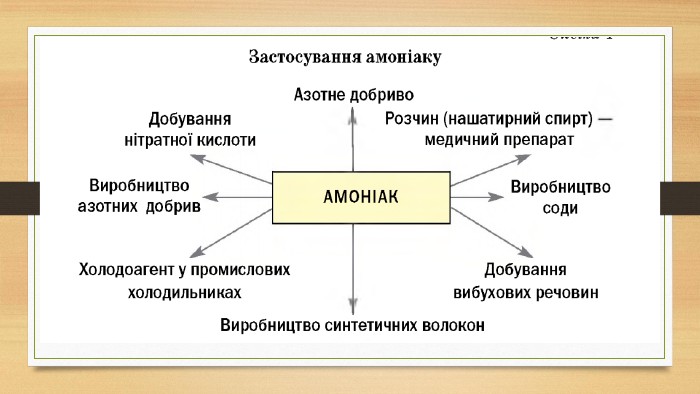
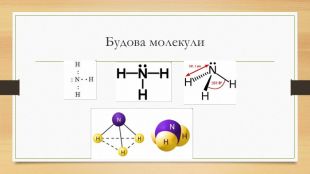
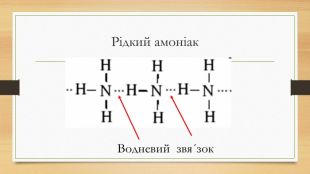
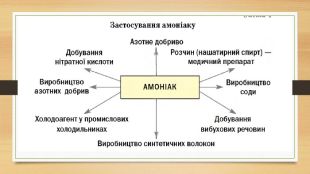
Презентація до уроку на тему "Амоніак"
Про матеріал
Презентація до уроку на тему "Сполуки неметалічних елементів з Гідрогеном", за допомогою презентації учні краще усвоюють матеріал
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
презентація добра, але є деякі помилки пов'язані з перекладом з російської


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку