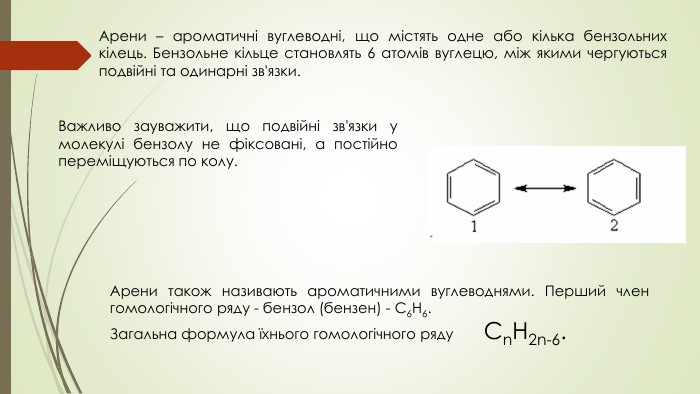
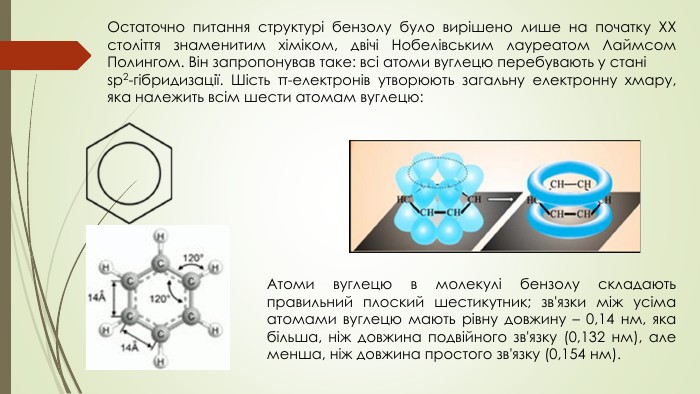
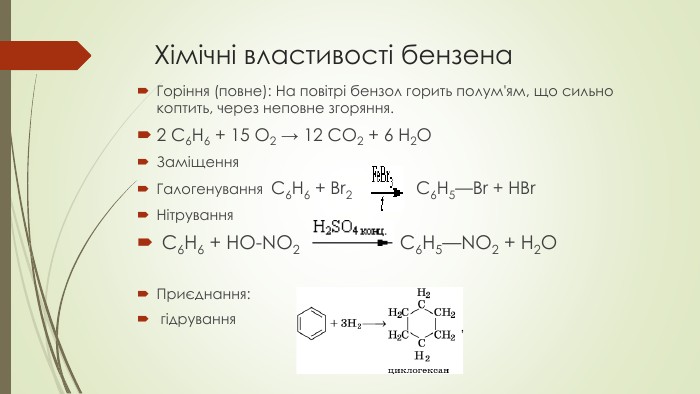
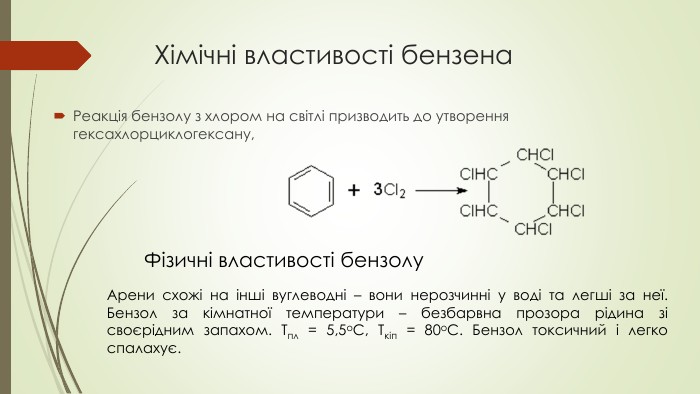
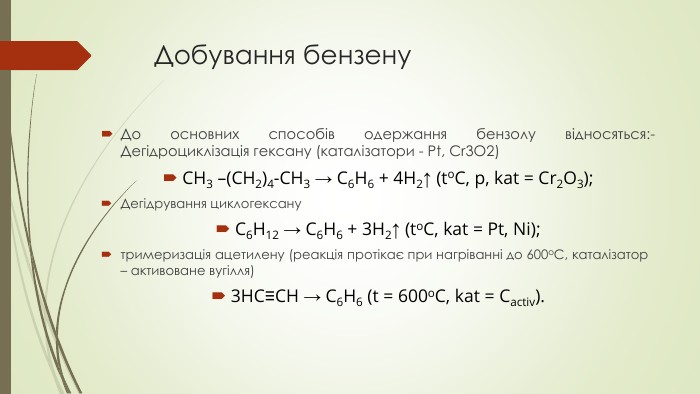
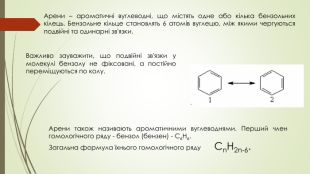
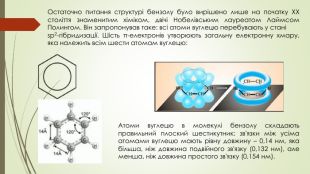
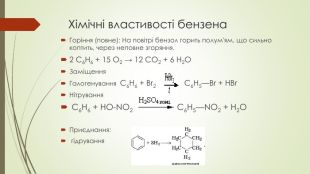
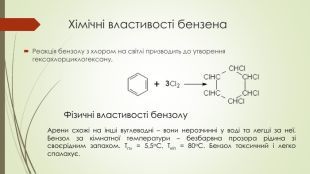
Презентація до уроку на тему "Бензен"
Про матеріал
Компактний виклад досить об'ємного матеріалу у вигляді мультимедійної презентації "Бензен" Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку