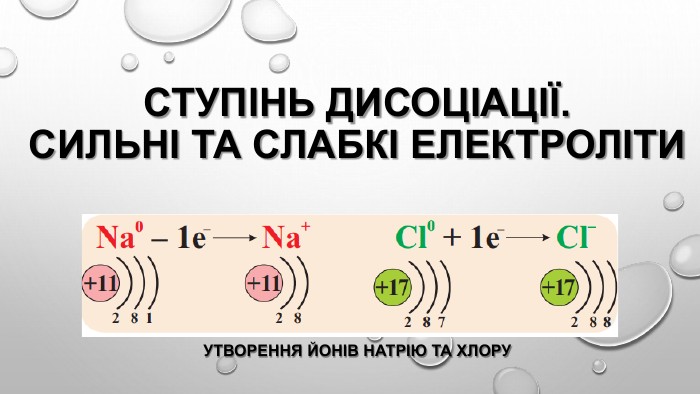
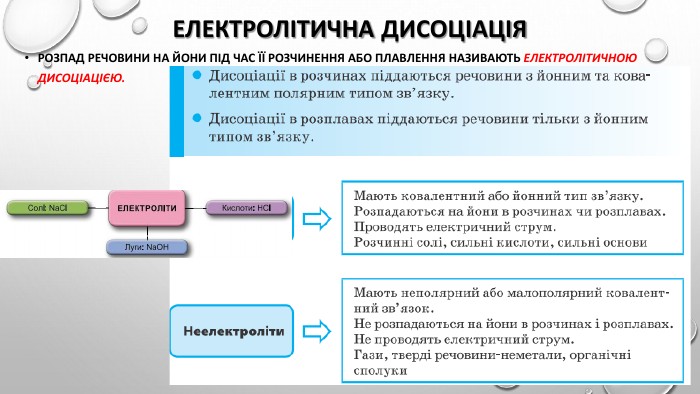
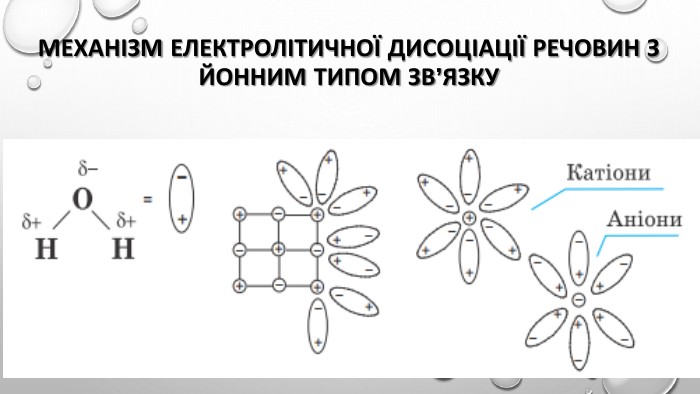
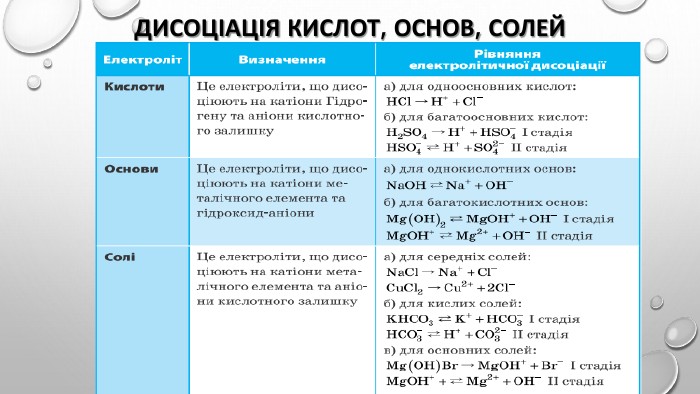
Презентація "Ступінь дисоціації. Сильні й слабкі електроліти"
Про матеріал
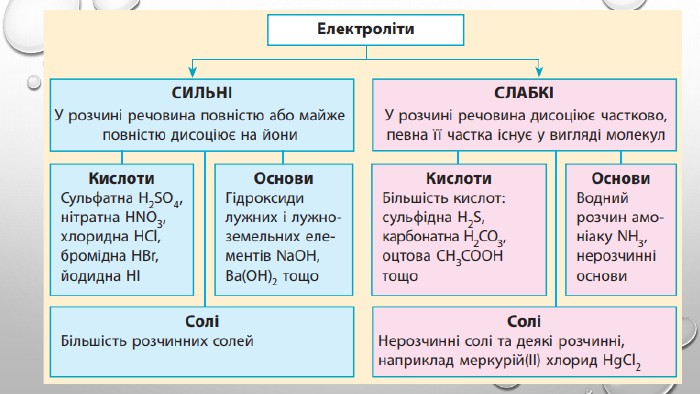
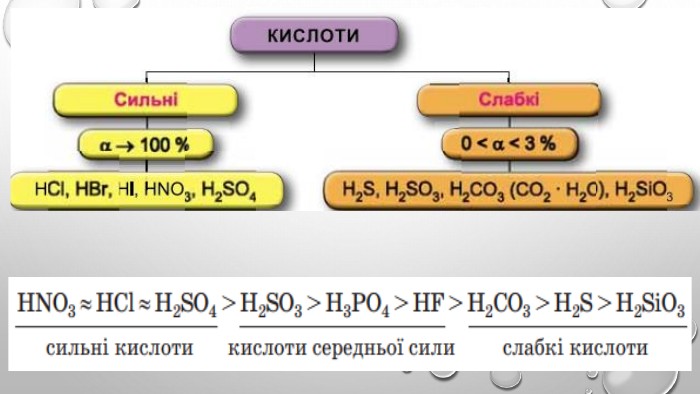
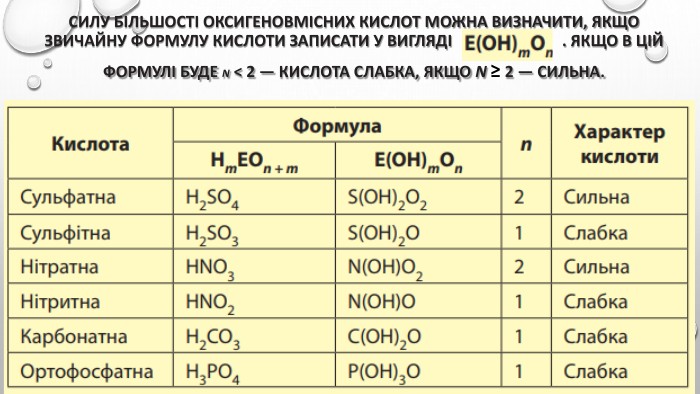
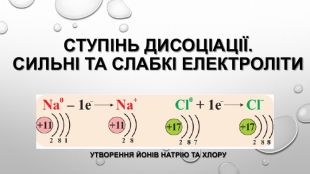
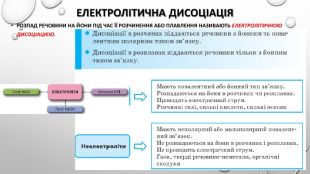
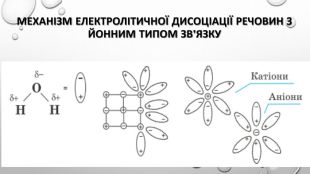
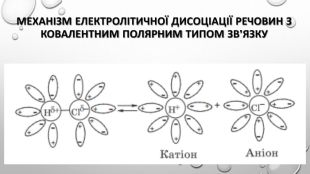
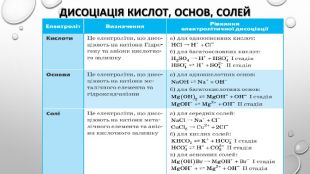
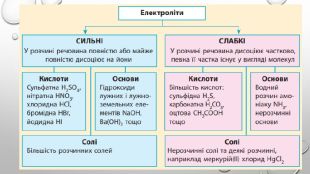
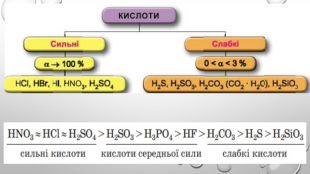
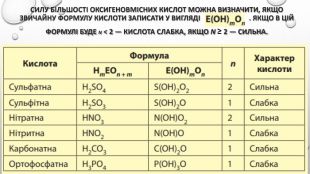
Містить пояснення поняття "ступінь дисоціації" та приклади розв'язування задач Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку