Презентація до уроку Кристалічні гратки. Залежність фізичних властивостей речовин від типів кристалічних ґраток
Про матеріал
Форми роботи: бесіда, розповідь, демонстрації, інтерактивний прийом «Мозковий штурм», «Точка зору», гра «Вірю не вірю», гра «Хімічна естафета», лабораторна робота
Методи та прийоми: словесні: бесіда, розповідь; наочні: демонстрація, комп'ютерна програма; практичний: лабораторний дослід, робота в групах.
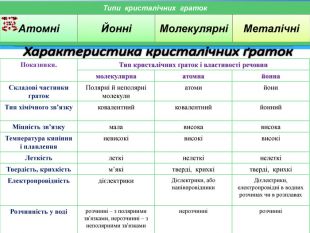
Обладнання та матеріали:Періодична система хімічних елементів
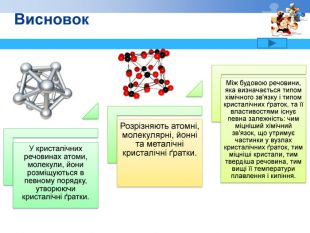
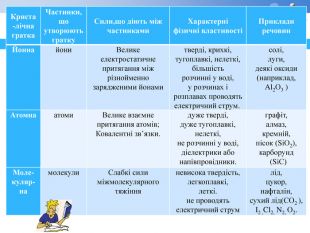
Д. І. Менделєєва, моделі кристалічних ґраток, приклади речовин з різними типами кристалічних ґраток, комп'ютерна програма(презентація), дидактичний роздатковий матеріал.
Мультимедійні засоби навчання: Комп'ютер, мультимедійний проектор, екран
Програмні ресурси: Презентація
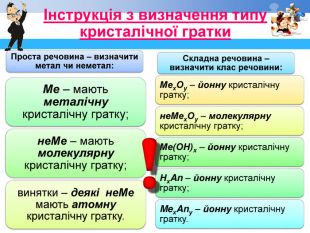
Друкований роздатковий матеріал: Інструкції по визначенню кристалічних граток
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку





























-

Переверзева Інна Євгенівна
15.10.2024 в 14:35
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Колесник Алла Володимирівна
05.12.2022 в 18:42
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Медведчук Тетяна
09.12.2021 в 09:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

фертак наталя
01.12.2020 в 20:52
Дякую, цікавий матеріал,змістовний
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Yacenko Olena
18.11.2020 в 19:17
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Супрун Ольга Петрівна
14.12.2019 в 21:27
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Душкіна Тетяна Олександрівна
25.11.2019 в 18:31
Дякую! Прекрасна презентація, чудово підібраний матеріал.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Задорожна Ніна Олександрівна
29.11.2018 в 01:20
вудова презентація, де потрібно є озвучка, цікаво, захоплююче. Дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 5 відгуків