Презенація «Хімічні властивості кислот» 8 клас
| Презентація допоможе в проведенні уроку на тему: «Хімічні властивості кислот: дія на індикатори, взаємодія з основними оксидами, основами, солями. Реакція нейтралізації. Реакції заміщення». |



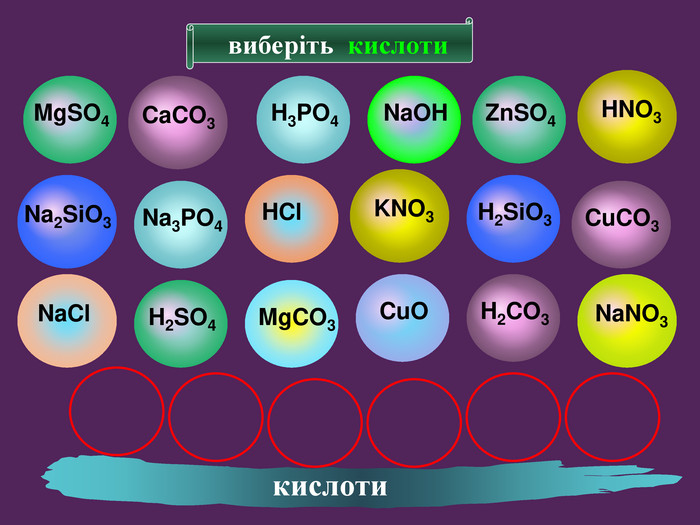











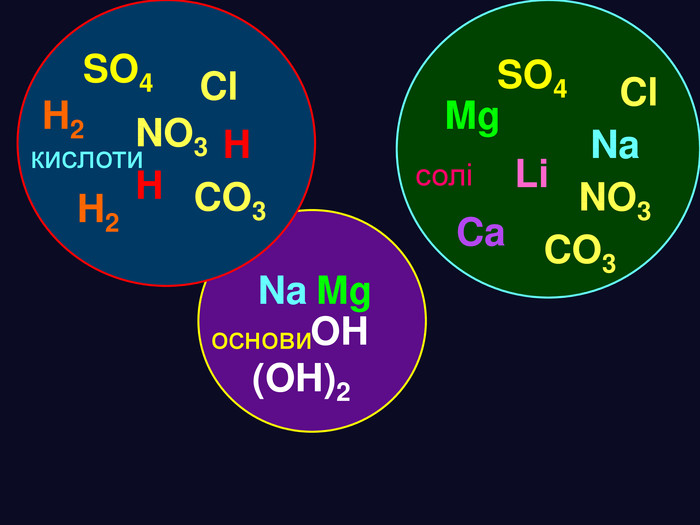






















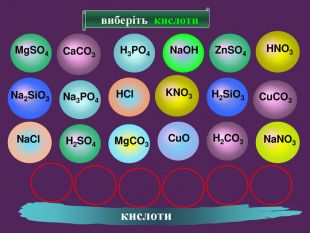
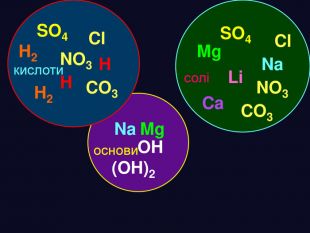
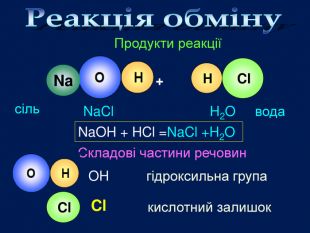
H2 SO4 HCl HNO3 H2 CO3 H2 Si. O3 Молекула кислоти складається з атомів Гідрогену і кислотного залишку Кислотний залишок це частина молекули кислоти, що сполучена з атомом (атомами) гідрогену. Валентність кислотного залишку визначається кількістю атомів Гідрогену в кислоті, здатних заміщуватись на атоми металів. Склад молекули кислоти
формула кислоти назва міжнародна назва поширена кислотний залишок назва залишку. HClхлориднасоляна – Cl хлорид. HNO3нітратнаазотна – NO3 нітрат. H2 SO4сульфатнасірчана = SO4 сульфат. H2 CO3карбонатнавугільна = CO3 карбонат. H2 Si. O3силікатнакремнієва = Si. O3 Силікат. H3 PO4ортофосфатнаортофосфорна = PO4 фосфат Кислоти Міжнародні назви кислот дають за назвою кислотного залишку
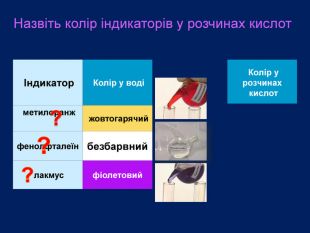
Кислоти можна визначити серед інших безбарвних розчинів за допомогою визначника (індикатора)Як можна визначити кислоту серед безбарвних розчинів інших речовин ?Індикатори ― це речовини, які змінюють забарвлення залежно від середовища (кислотне, лужне, нейтральне)фенолфталеїн метилоранж лакмус. В нейтральному середовищиколір
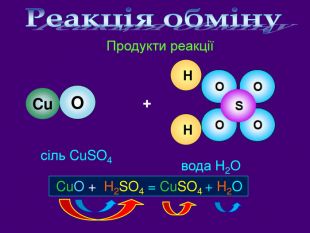
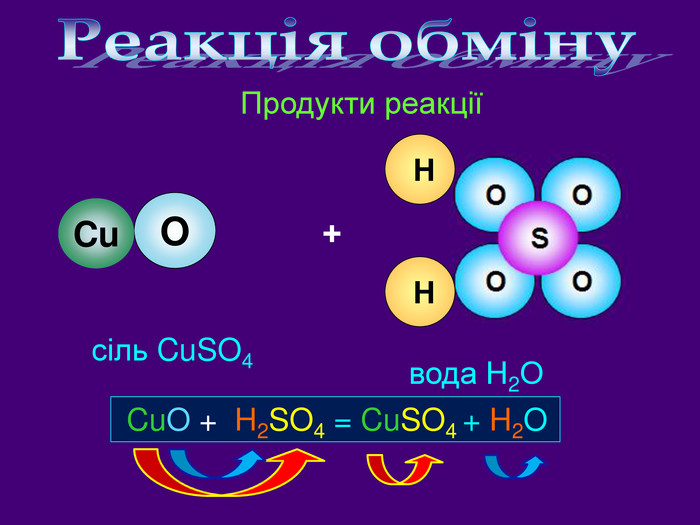
Які продукти реакції? Назвіть їх. Які вихідні речовини ви використали? Назвіть їх взаємодія сульфатної кислоти з купрум (ІІ) оксидом. H2 SO4 + Cu. O → Cu. SO4 + H2 OОсновні оксиди взаємодіють з кислотами утворюють сіль та воду Основний оксид + кислота = сіль + водаvideo. H2 Oдо реакції після реакціїВзаємодія кислот з основними оксидами. Cu. OCu. SO4
Які продукти реакції? Назвіть їх. Які вихідні речовини ви використали? Назвіть їх взаємодія сульфатної кислоти з ферум(ІІІ) оксидом. Основні оксиди взаємодіють з кислотами утворюють сіль та воду Основний оксид + кислота = сіль + водаvideo. H2 Oдо реакції після реакціїВзаємодія кислот з основними оксидами. Fe2 O3 + HCl → Fe. Cl3 + 3 H2 OFe2 O3 Fe. Cl36 2
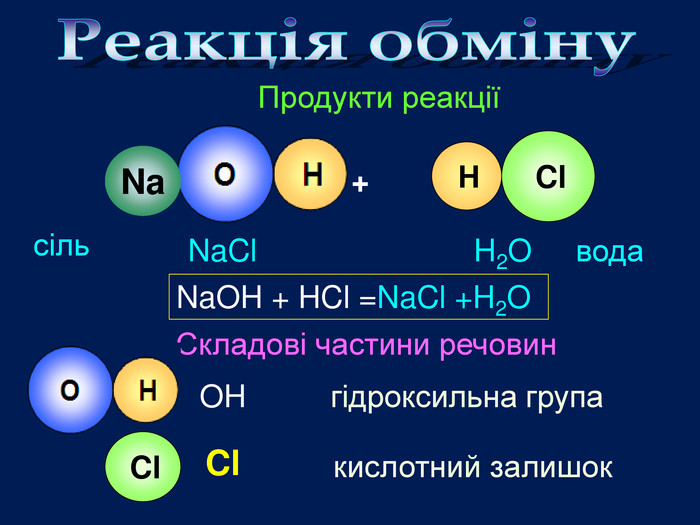
video Взаємодія кислот з основами. Кислота + основа = сіль + вода Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції;Які вихідні речовини ви використали? Назвіть їх. Натрій гідроксид фенолфталеїн. Які продукти реакції? Назвіть їх натрій хлорид НCl + Na. OН = Na. Cl + Н2 O Напишіть рівняння реакціїХлоридна кислота. Na. OН НCl Na. Cl
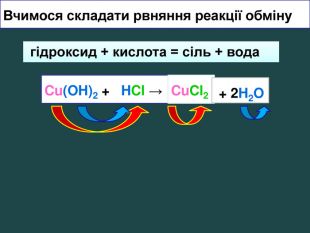
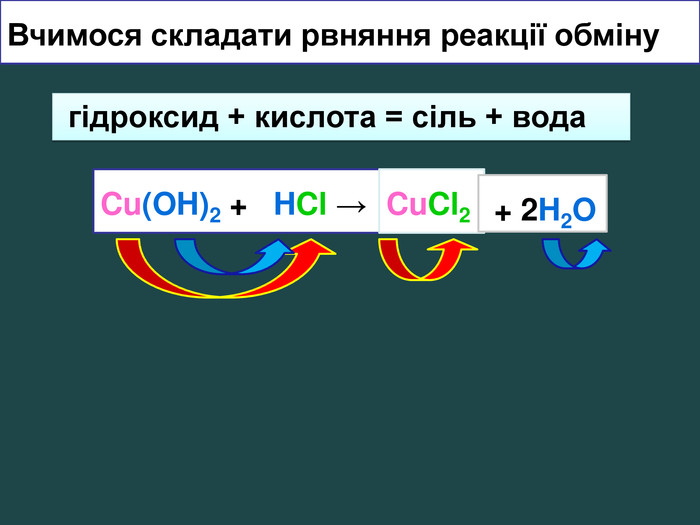
Взаємодія кислот з основами video. Які вихідні речовини ви використали? Назвіть їх. Які продукти реакції? Назвіть їх Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції;купрум хлорид лоридна кислота купрум гідроксид. НCl. Cu(OН)2 Cu. Cl2 + 2 H2 OCu(OH)2 + 2 HCl → гідроксид + кислота = сіль + вода. Cu. Cl2
Взаємодія кислот з основами Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції;Які вихідні речовини ви використали? Назвіть їх ферум (ІІІ) гідроксид. Хлоридна кислота. Ферум (ІІІ) хлорид. Напишіть рівняння реакціїFe(OН)3+ HCl =Fe. Cl 3 + Н2 Ovideo. Fe(OН)3 HCl. Fe. Cl 333 Які продукти реакції? Назвіть їх
video Взаємодія кислот з основами Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції;Які вихідні речовини ви використали? Назвіть їх ферум (ІІ) гідроксид. Хлоридна кислота. Ферум (ІІ) хлорид. Напишіть рівняння реакціїFe(OН)2+ HCl =Fe. Cl 2 + Н2 OЯкі продукти реакції? Назвіть їх. HCl. Fe. Cl 3 Fe(OН)222
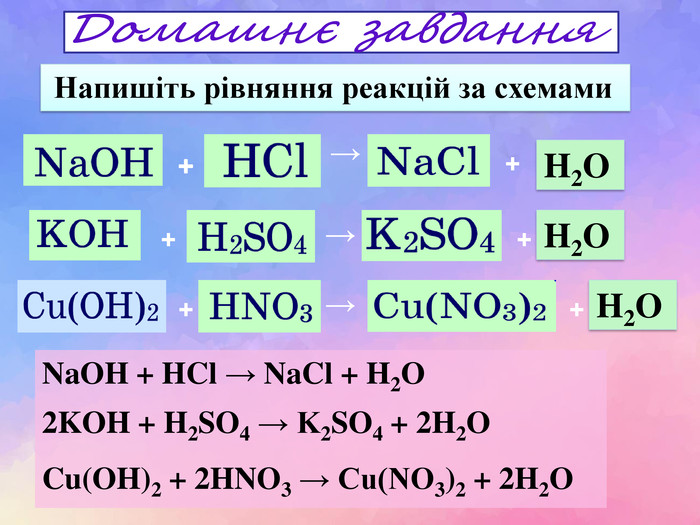
Схема взаємодіїкислота + основа = сіль + вода. H2 SO4 Na. OH Н2 О Na2 SO4 + = + 2 Взаємодія кислот з основами{284 E427 A-3 D55-4303-BF80-6455036 E1 DE7} Реакція між основами і кислотами, в результаті яких утворюються сіль і вода, називаються реакціями нейтралізації. Завдання: Із поданих речовин складіть рівняння реакції між кислотою та основою рівняння реакції
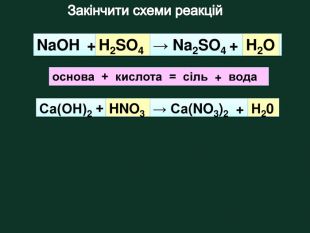
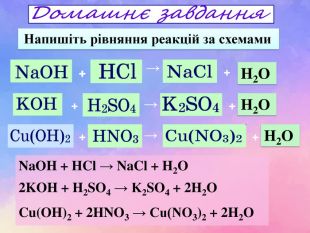
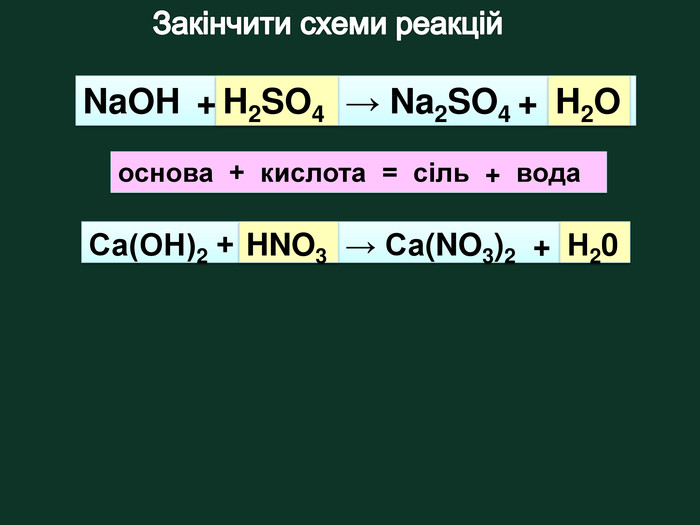
?? Na. OH + HCl = Na. Cl + H2 O2 KOH + H2 SO4 = K2 SO4 + 2 H2 OCu(OH)2 + 2 HNO3 = Cu(NO3)2 + 2 H2 O НNO3 Na. OH K2 SO4 Cu(OH)2 НСl Cu(NO3)2 KOHЗавдання: Складіть рівняння реакції між основою та кислотою (реакція нейтрализації) Основа + кислота → сіль + Н2 О Н2 О Н2 О Н2 О? Na. Cl?Н2 SO4
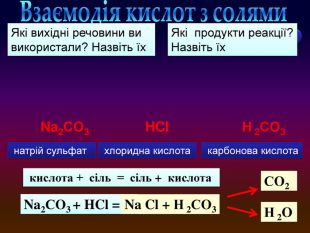
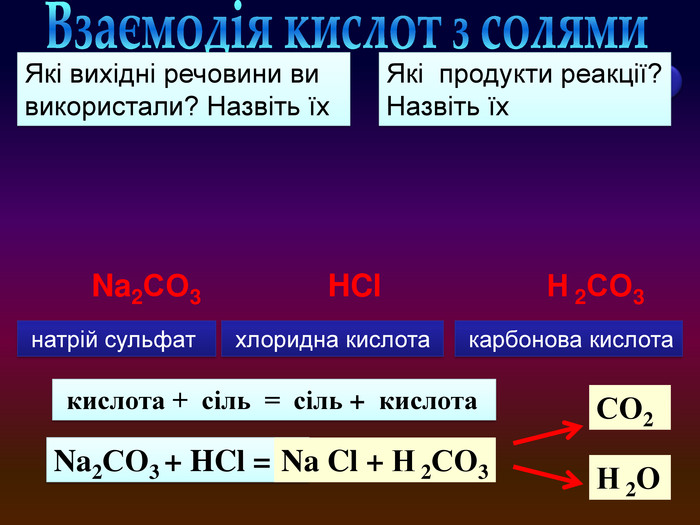
Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції; кислота + сіль = сіль + кислотаvideo Взаємодія кислот з солями натрій сульфат карбонова кислота хлоридна кислота. Які вихідні речовини ви використали? Назвіть їх. Які продукти реакції? Назвіть їх. Na2 СO3 + HCl = Na Cl + Н 2 СO3 Na2 СO3 HCl. Н 2 O СO2 Н 2 СO3
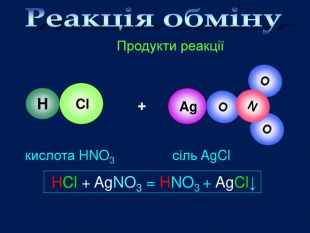
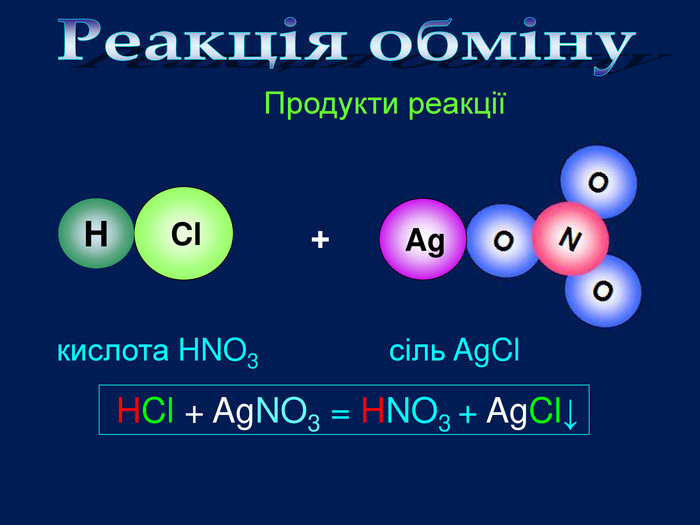
Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції;Схема взаємодії кислота + сіль = кислота + сіль Складіть рівняння реакціїvideo Взаємодія кислот з солями. HCl Ag. Cl. HCl + Ag. NO3 = HNO3 + Ag. Cl↓хлоридна кислотааргентум хлоридаргентум нітрат. Які вихідні речовини ви використали? Назвіть їх. Які продукти реакції? Назвіть їх. Ag. NO3
Завдання: перегляньте відео,назвіть вихідні речовини та продукти реакції;Схема взаємодії кислота + сіль = кислота + сіль Складіть рівняння реакціїvideo Взаємодія кислот з солями сульфатна кислотабарій сульфатбарій хлорид. Які вихідні речовини ви використали? Назвіть їх. Які продукти реакції? Назвіть їх Н2 SO4 + Ba. Cl2 = 2 НCl + Ba. SO4↓ Н2 SO4 Ba. Cl2 Ba. SO4
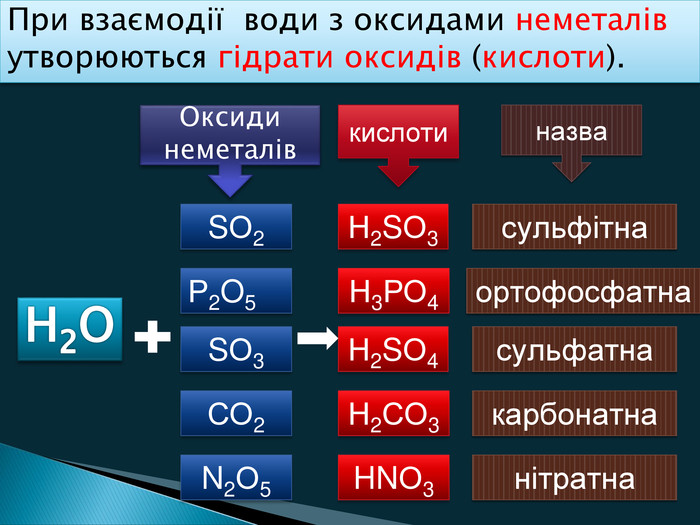
Кислоти можна одержати одним із способів Взаємодією кислотних оксидів з водою Взаємодією водних розчинів солі і кислоти Взаємодією неметалів з Гідрогеном і розчинення отриманої сполуки у водівода + кислотний оксид = кислота H2 O + СO3 =H2 СO3 кислота + сіль = кислота + сіль. H2 SO4 + Ba. Cl2 2 HCl + Ba. SO4H2+ Cl2 2 HCl video Одержання кислот
Григорович О. В. Хімія.8 клас: Розробки уроків —Х.: Вид-во “Ранок”, 2008. Ярошенко О. Г. Хімія: підруч. для 8 кл. загальноосвіт. навч. закл. Освіта, 2008. Шаповалов С. А. Довідник старшокласниката абітурієнта. Х. Торсінг, 2005. Хімія. 8 клас І. Ю. Старовойтова, О. В. Люсай. — X. : Вид. група «Основа», 2009. — 128 с. — (Серія «Мій конспект»). Джерела
-
 Рівна Світлана Анатоліївна 08.04.2020 в 19:25Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Рівна Світлана Анатоліївна 08.04.2020 в 19:25Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0 -
 Паращак Наталія Миколаївна 28.03.2018 в 14:59=Загальна:4.7Структурованість4.0Оригінальність викладу5.0Відповідність темі5.0
Паращак Наталія Миколаївна 28.03.2018 в 14:59=Загальна:4.7Структурованість4.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку