Презентація до уроку на тему"Складання формул за валентностями"
Про матеріал
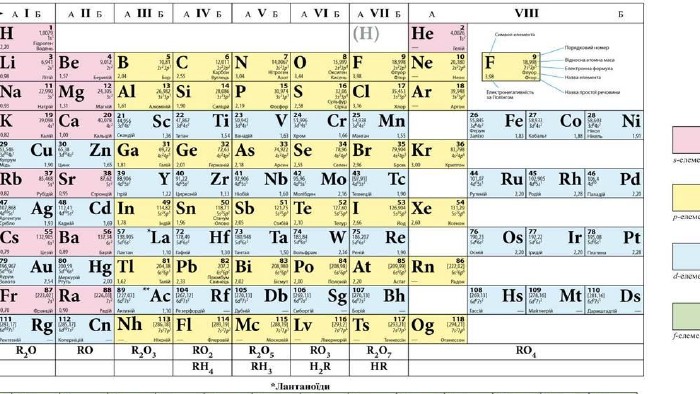
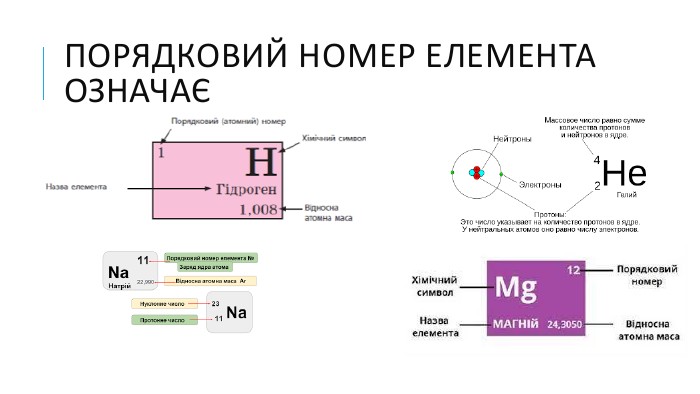
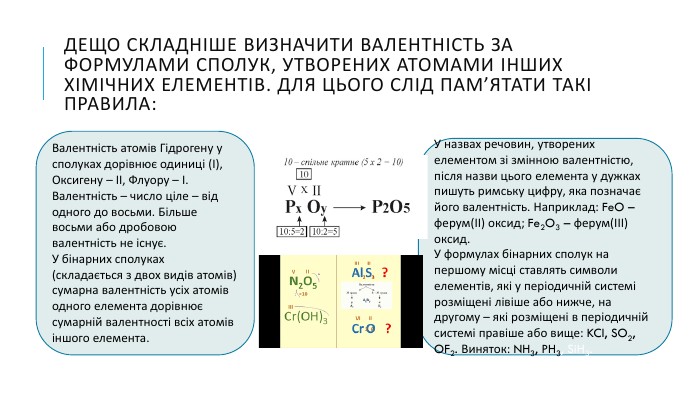
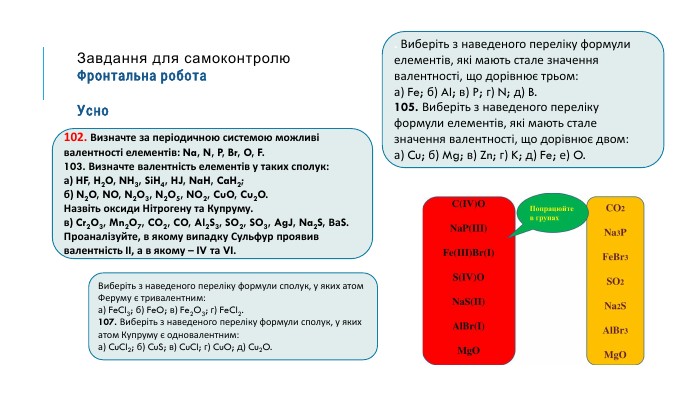
МЕТА: освітня: продовжити знайомити здобувачів освіти із поняттям «валентність», формувати навички розставляти валентності елементів і складати формули бінарних сполук за валентністю; розвивальна: формувати навички користуватися періодичною системою як джерелом інформації; виховна: виховувати допитливість, прагнення брати активну участь у пошуку нових знань. Перегляд файлу
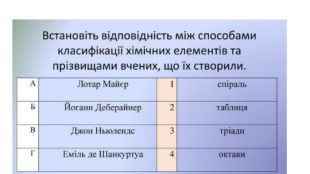
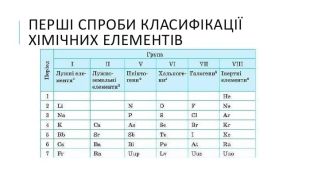
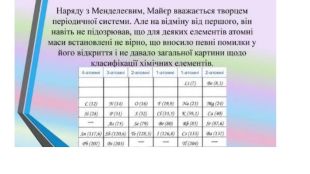
Зміст слайдів

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку