Презентація до уроку "Окисно-відновні реакції"
Про матеріал
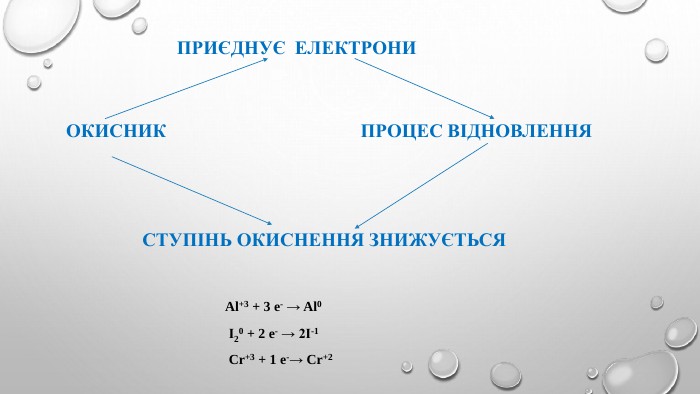
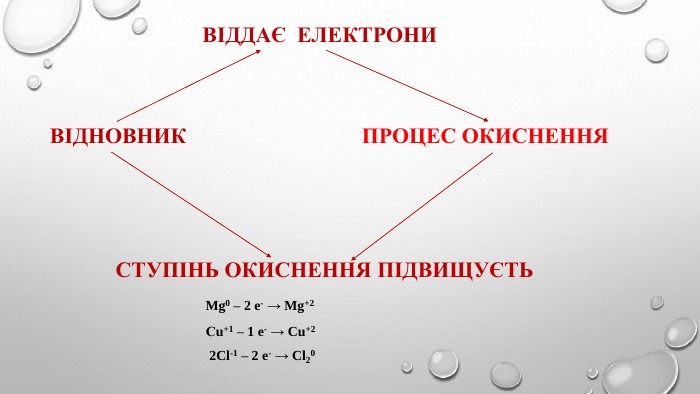
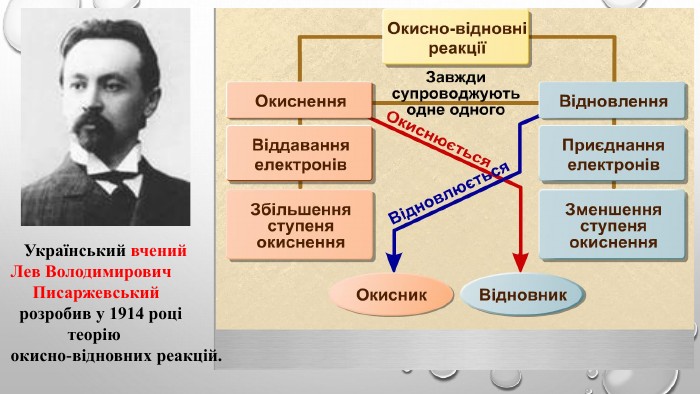
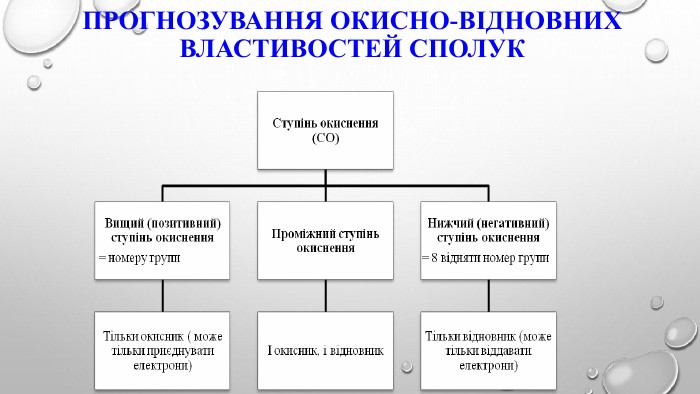
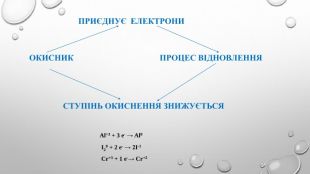
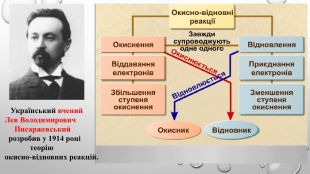
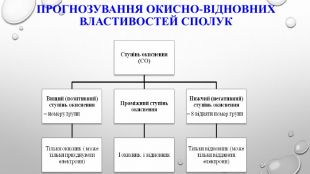
Поняття про окисно-відновні реакції, процеси окиснення та відновлення, окисники та відновники, взаємозв'язок показника ступення окиснення з характером окисно-відновних властивостей сполуки, алгоритм складаня рівнянь окисно-відновних процесів. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку