Презентація до уроку: Поняття про рН розчину. Лабораторні досліди 1-3"
Про матеріал
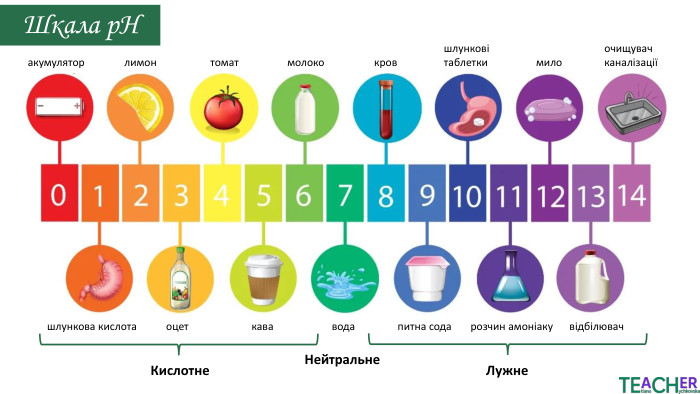
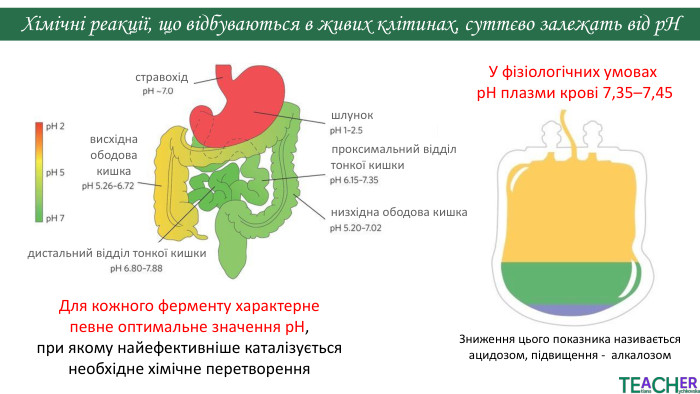
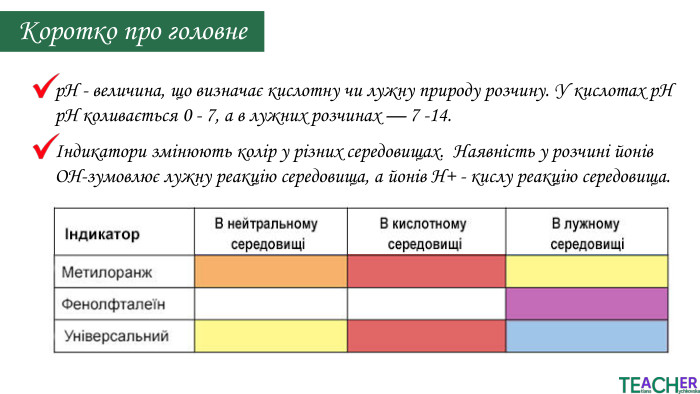
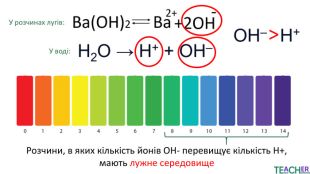
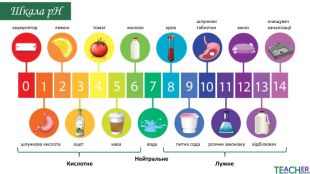
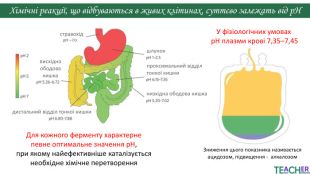
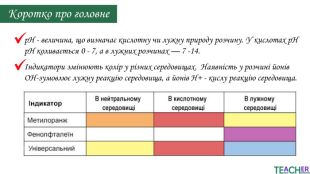
У презентації подано поняття рН розчину, проілюстровано прикладами, доведено значення для живих організмів. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
-
Дуже дякую!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку