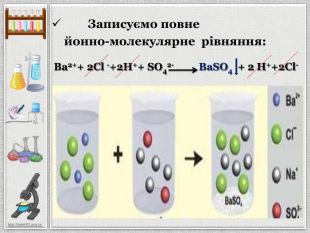
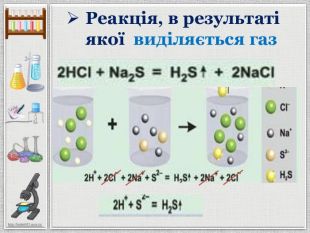
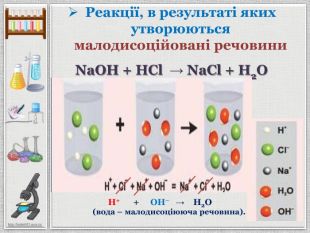
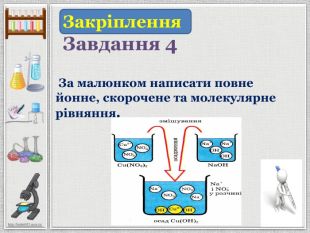
Презентація до уроку "Реакції йонного обміну"
Про матеріал
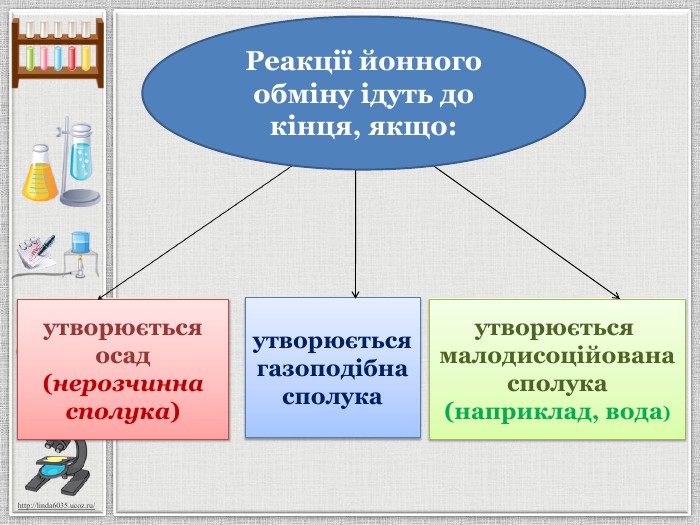
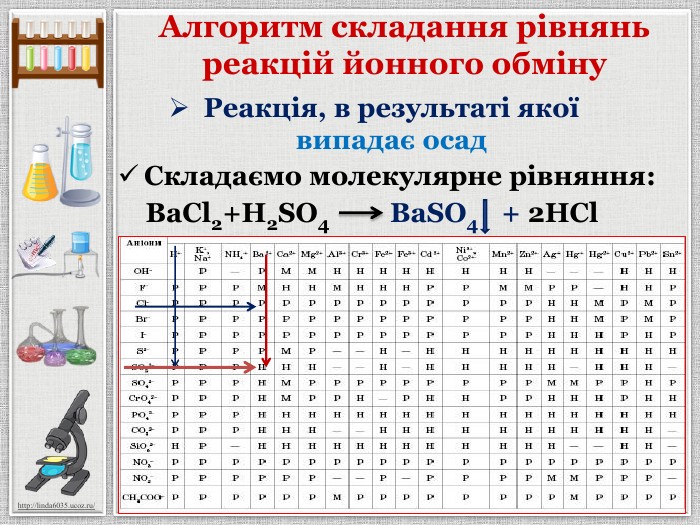
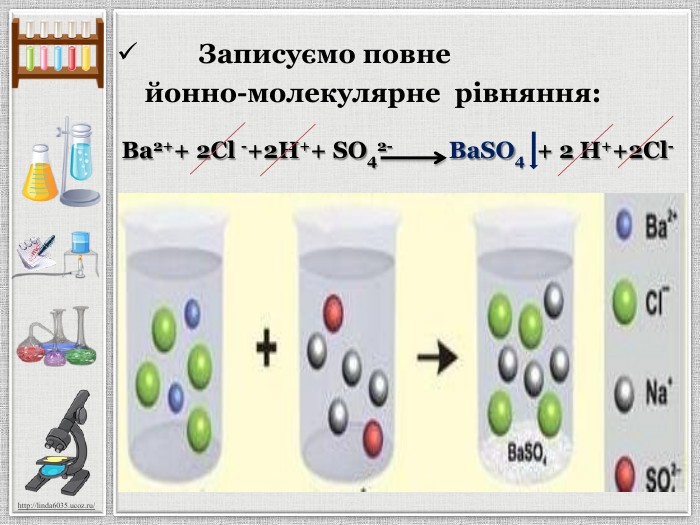
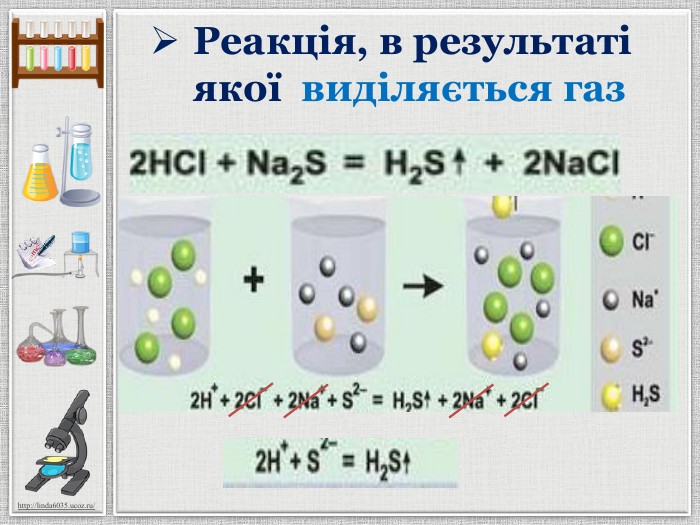
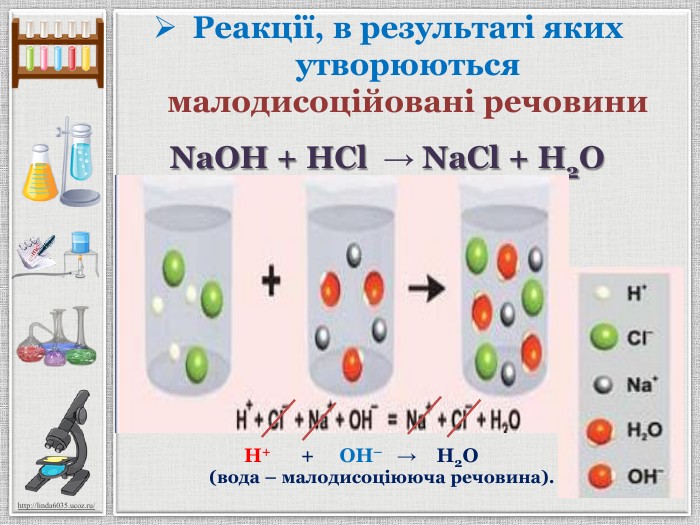
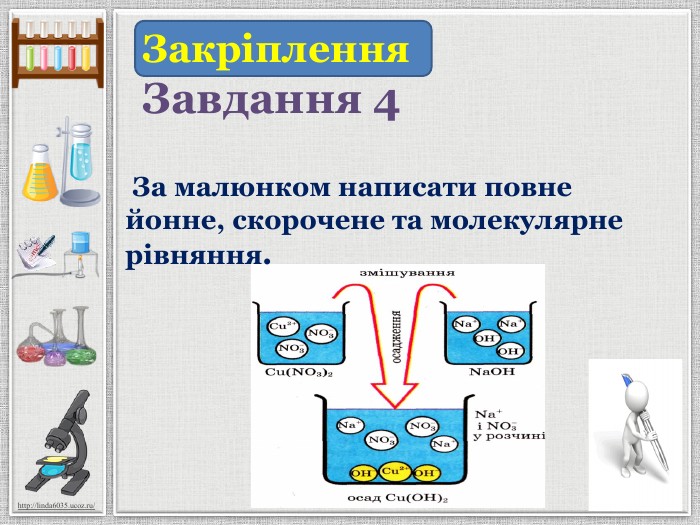
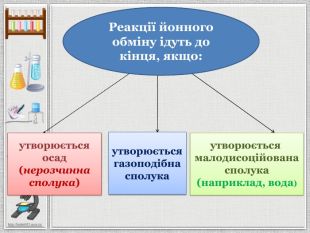
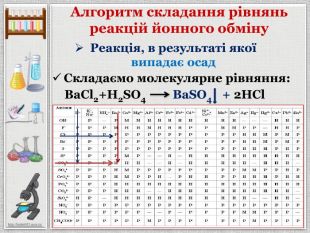
Презентація уроку створена для опрацювання теми про реакції йонного обміну, причини та умови їх здійснення; сформувати вміння складати повні та скорочені йонно-молекулярні рівняння реакцій йонного обміну, пояснювати їх механізм з погляду теорії електролітичної дисоціації; продовжити розвивати навички складання рівнянь дисоціації речовин, роботи з таблицею розчинності; розвивати вміння спостерігати, порівнювати та робити висновки. Всі етапи уроку побудовані з використанням інноваційних засобів навчання. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку