Презентація до уроку: "Розрахунки за хімічними рівняннями"
Про матеріал
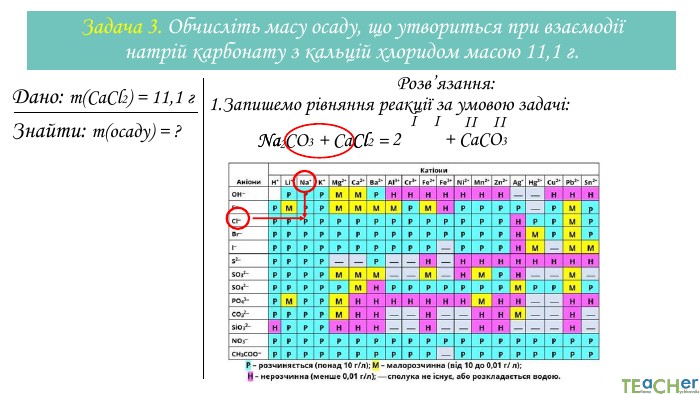
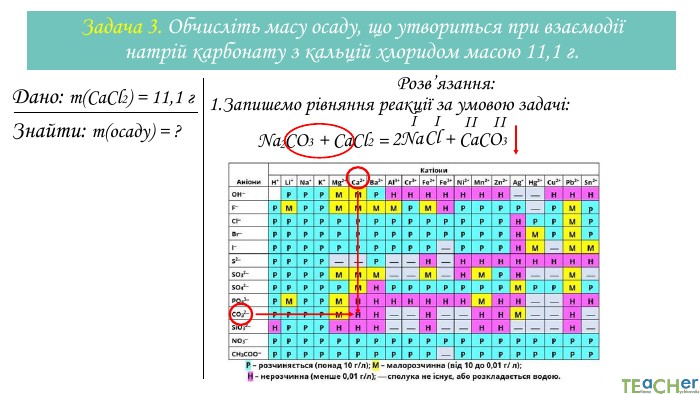
У презентації розглянуто розвязування типових задач з хімії, де використовуються розрахунки за хімічними рівняннями. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку

































-

Переверзева Інна Євгенівна
28.01.2024 в 20:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Kiriyenko Olena
30.04.2023 в 12:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Орловська Наталія Вікторівна
01.03.2023 в 23:40
Ваші презентації неймовірні, 100% влучання.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Хворостяна Вікторія Василівна
19.08.2022 в 08:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пашаєва Тетяна Миколаївна
04.04.2022 в 12:15
Дуже дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука