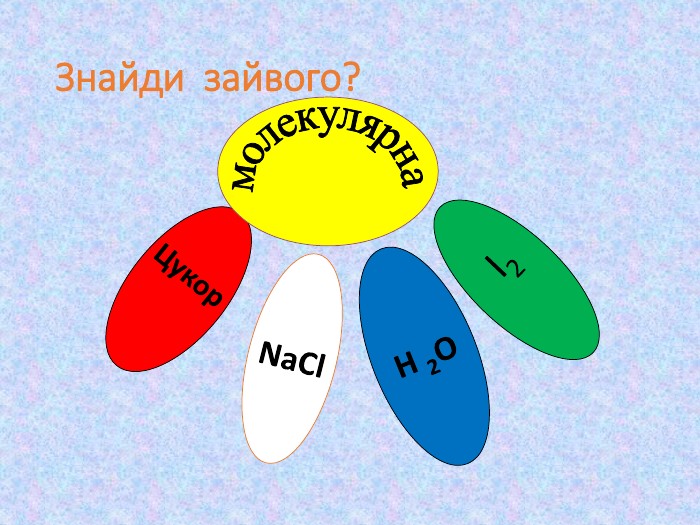
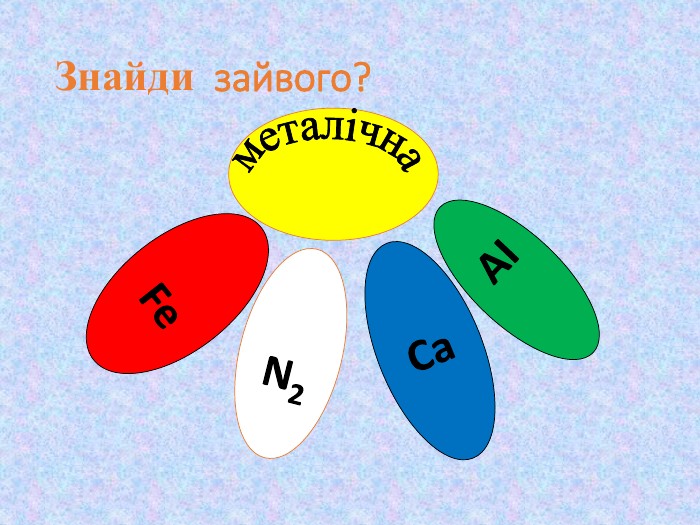
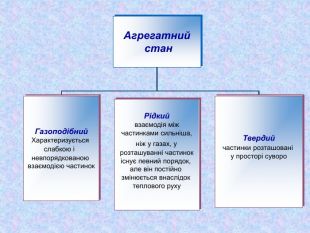
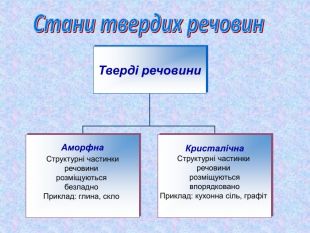
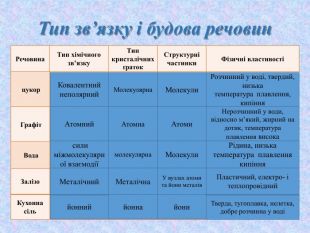
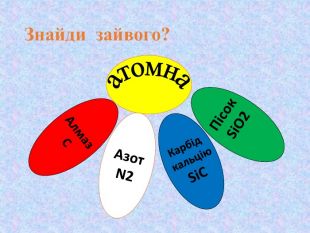
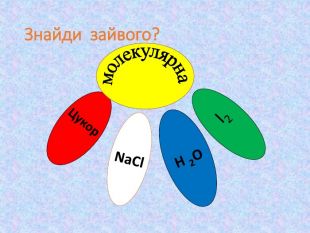
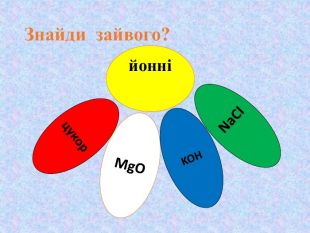
Кристалічні ґратки. Атомні, молекулярні та йонні кристали. Залежність фізичних властивостей речовин від типів кристалічних ґратки
Про матеріал
Презентація до уроку хімії у 8 класі "Кристалічні ґратки. Атомні, молекулярні та йонні кристали. Залежність фізичних властивостей речовин від типів кристалічних ґратки" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку





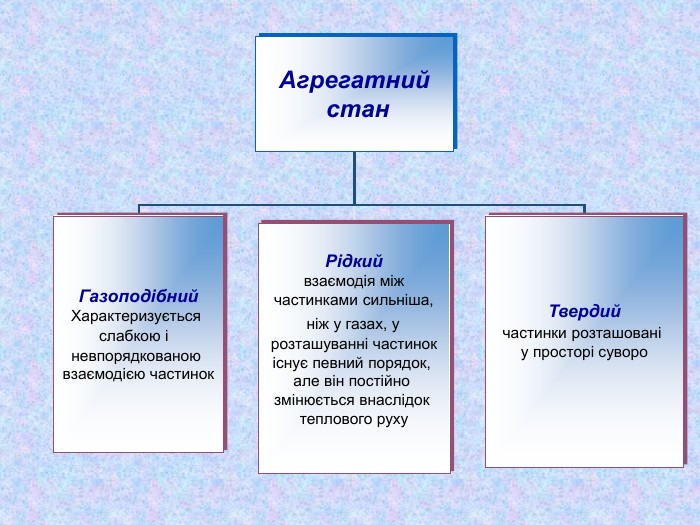
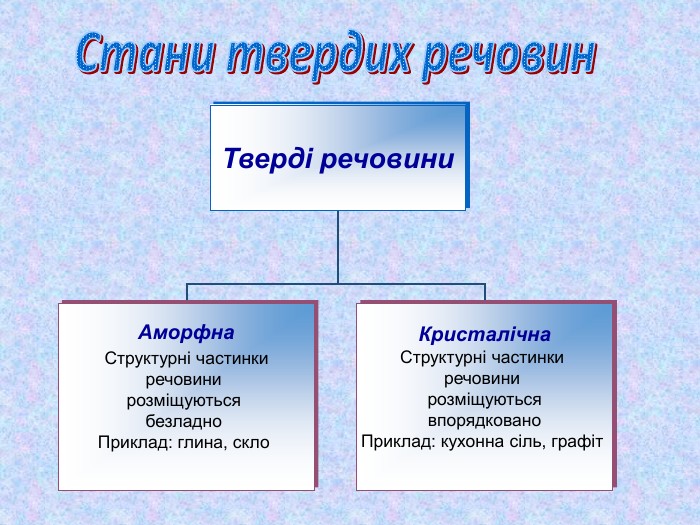
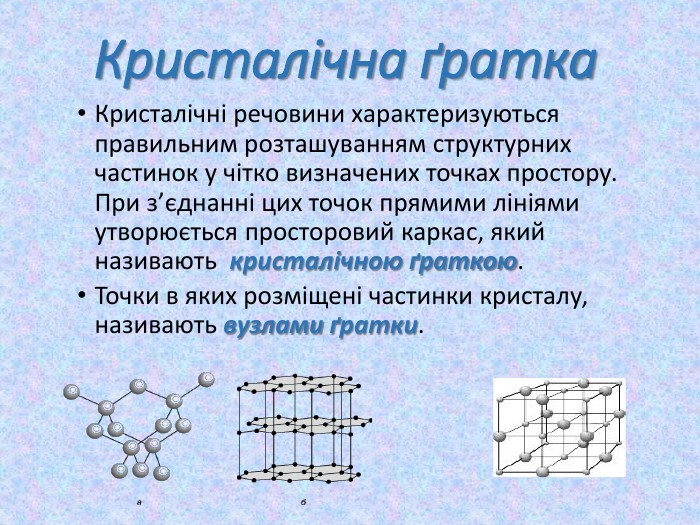
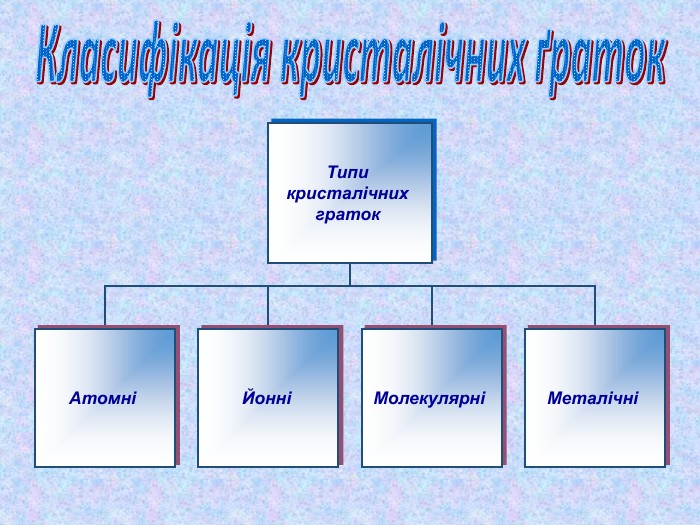


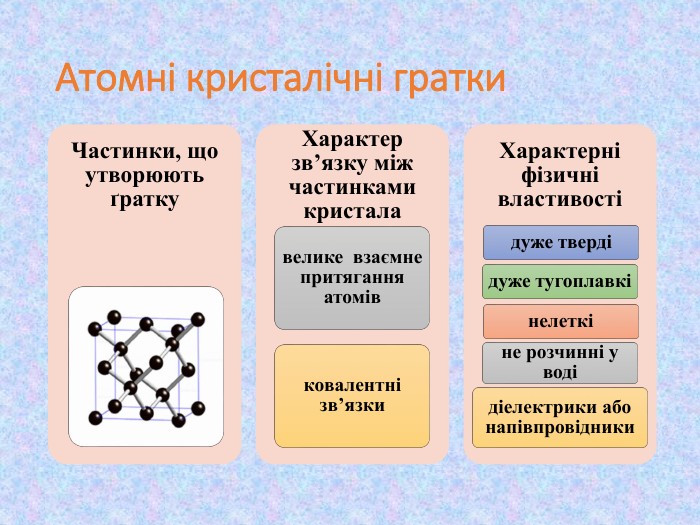

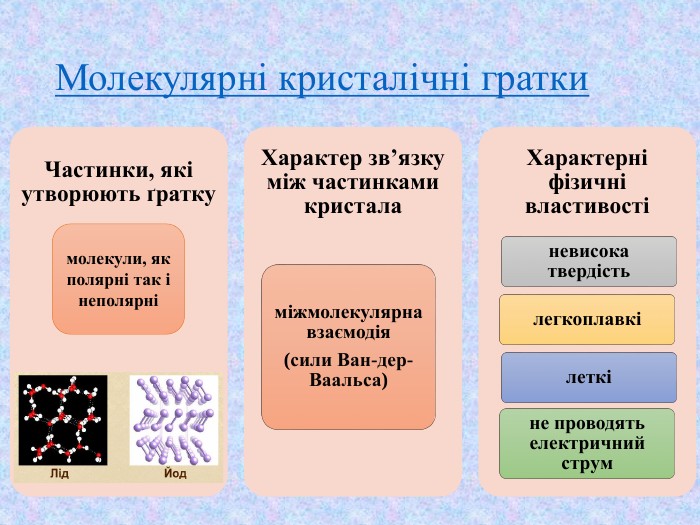



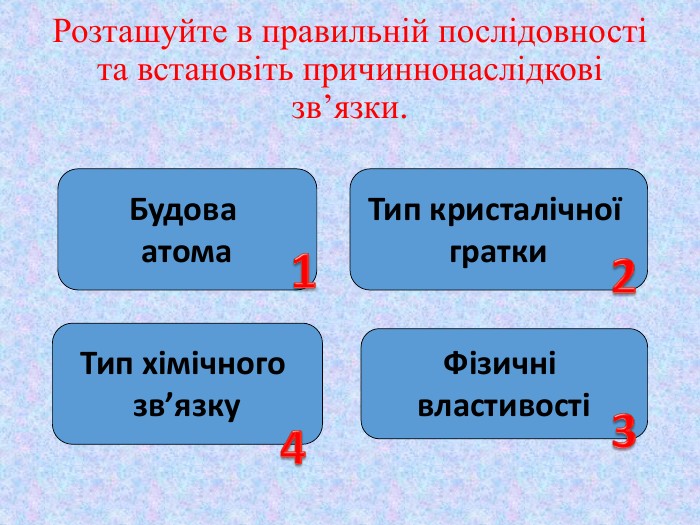



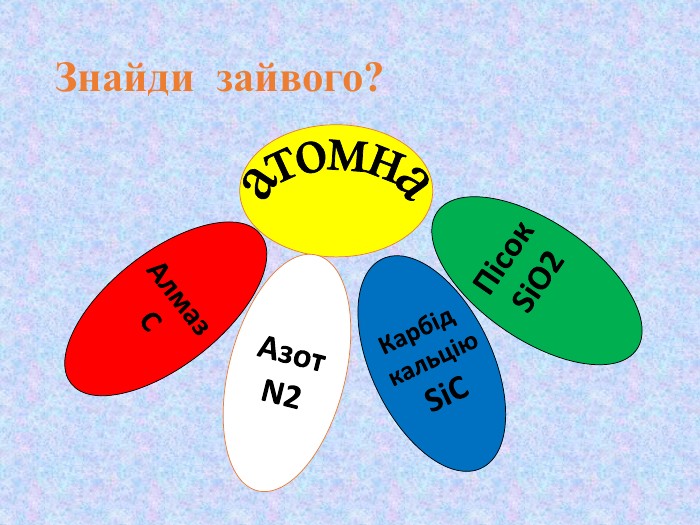






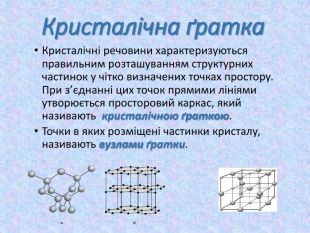
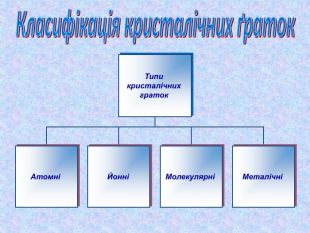


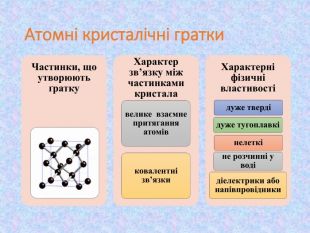

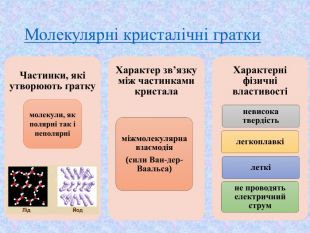







-

Звягіна Людмила Клавдіївна
17.11.2024 в 09:52
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Emofer
16.11.2024 в 20:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сулік Оксана Петрівна
18.01.2024 в 11:31
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
30.11.2022 в 11:36
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
26.11.2022 в 20:39
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука