Ряд активності металів. Реакції заміщення.





















Складіть формулу або назвуІ варіант. Р2 О5 Бромідна кислота. Nа2 ОКарбонатна кислота. Ферум(ІІІ) оксид. Нітритна кислота. Хлор(ІV) оксид. Сульфатна кислота. Цинк оксид. Сульфідна кислота. Метафосфатна кислотаІІ варіант. SО2 Йодидна кислота. Мg. ОНітратна кислота. Аурум(ІІІ) оксид. Силікатна кислота. Нітроген (V) оксид. Сульфітна кислота. Калій оксид. Ортофосфатна кислота. Флуоридна кислота
Усі метали, які в ряду активності розташовані ліворуч від Гідрогену, здатні витискувати водень із розчинів кислот. Ті метали, які розташовані після Гідрогену, під час взаємодії з розчинами кислот водень не витискують. Винятком є нітратна кислота, реакції її взаємодії з металами відбуваються більш складно.
Літій взаємодіє з водою дуже бурхливо: Калій реагує з водою так бурхливо, що часто відбувається вибух: під час реакції виділяється така велика кількість теплоти, що водень, який виділяється, загоряється і спричиняє загоряння самого металу. Кальцій і натрій взаємодіють з водою так само бурхливо, але без вибуху: Утворення лугів у реакції активних металів із водою можна довести, якщо додати розчин фенолфталеїну, який набуває характерного малинового забарвлення
Магній взаємодіє з водою за такою самою схемою, як і активні метали, але замість лугу утворюється нерозчинна основа. Реакція відбувається настільки повільно, що спершу при додаванні магнію до води ніякої реакції не спостерігається — пухирці водню починають виділятися через деякий час
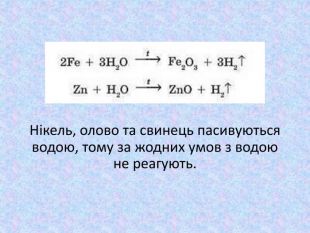
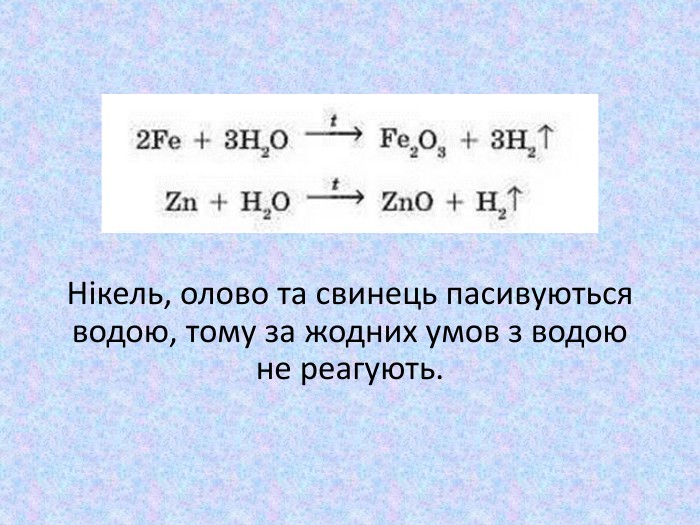
Більшість інших металів, розташованих між магнієм та воднем у ряду активності, також можуть взаємодіяти з водою (витискувати з неї водень), але це відбувається за «жорсткіших» умов: для цього крізь розпечені металічні ошурки пропускають перегріту водяну пару. Звичайно, що за таких умов гідроксиди розкладаються (на оксид та воду), тому продуктами реакції є оксид відповідного металічного елемента і водень:
Мідь можна витиснути із солі будь-яким металом, розташованим ліворуч від міді в ряду активності металів. При цьому мідь буде витісняти з розчинів інших солей будь-який метал, що розташований у ряду активності праворуч від неїНайактивніші метали, що розташовані на самому початку ряду, — натрій, калій — не витісняють інші метали з розчинів солей, оскільки вони настільки активні, що взаємодіють не з розчиненою сіллю, а з водою, у якій ця сіль розчинена.
Взаємодія металів з оксидами. Оксиди металічних елементів також здатні взаємодіяти з металами. Активніші метали витискують менш активні з оксидів. Але на відміну від взаємодії металів із солями, у даному випадку оксиди необхідно розплавити, щоб реакція відбулась:сіль (1) + метал (1) = сіль (2) + метал (2)
Для добування металу з оксиду можна застосовувати будь-який метал, що розташований у ряду активності ліворуч, навіть найактивніші натрій і калій, адже в розплавленому оксиді води немає: Витіснення металів із солей або оксидів активнішими металами дуже широко застосовується в промисловості для добування металів.
Закріплення вивченого матеріалу1. запиши рівняння можливих реакцій відповідно до схем:а) барій оксид + сульфітна кислота → __________________________________________________б) купрум(ІІ) гідроксид + ортофосфатна кислота → __________________________________________________в) магній + сульфатна кислота →__________________________________________________г) натрій карбонат + хлоридна кислота →__________________________________________________д) срібло + хлоридна кислота →__________________________________________________


про публікацію авторської розробки
Додати розробку