Презентація до уроку: "Стан електронів в атомі. Електронні орбіталі. Енергетичні рівні та підрівні"
Про матеріал
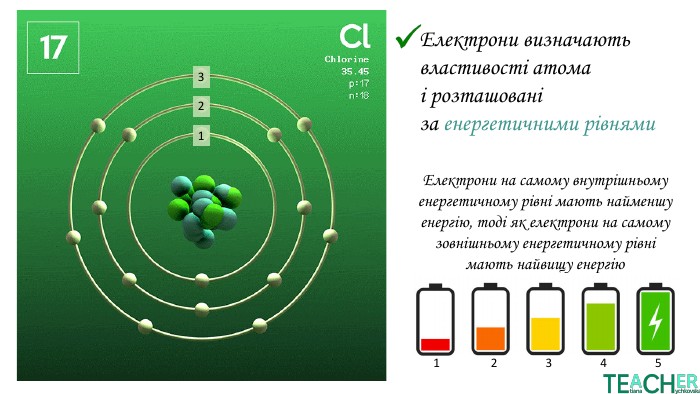
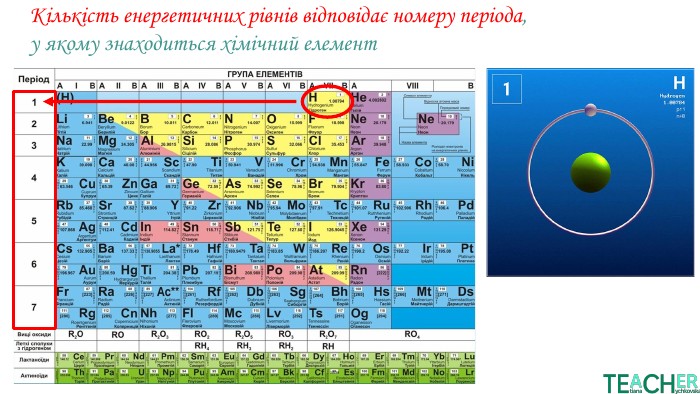
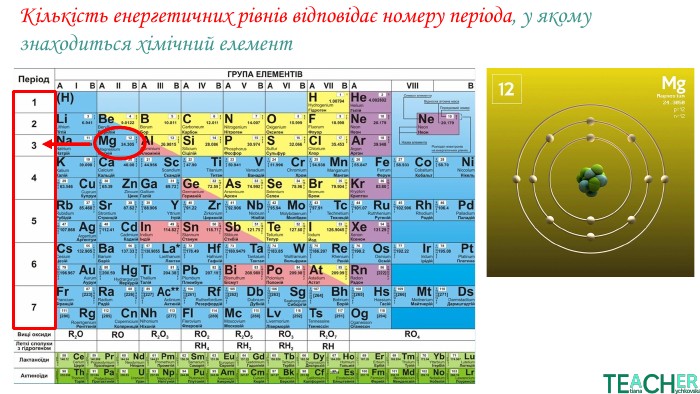
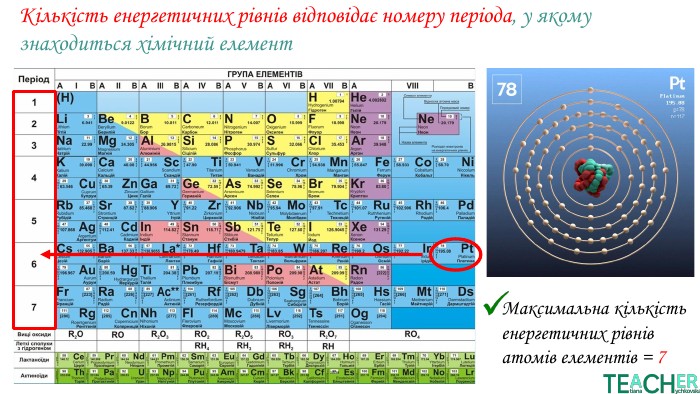
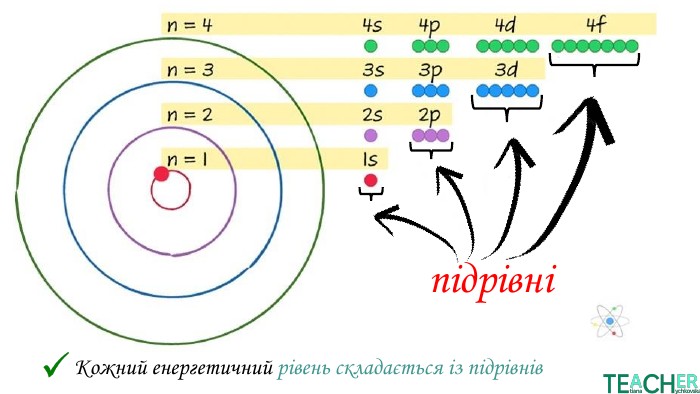
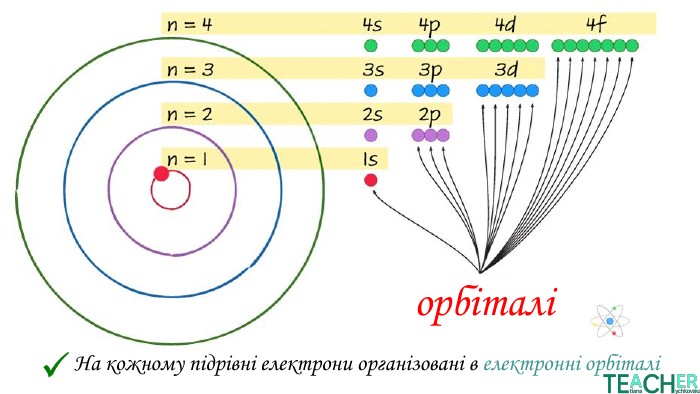
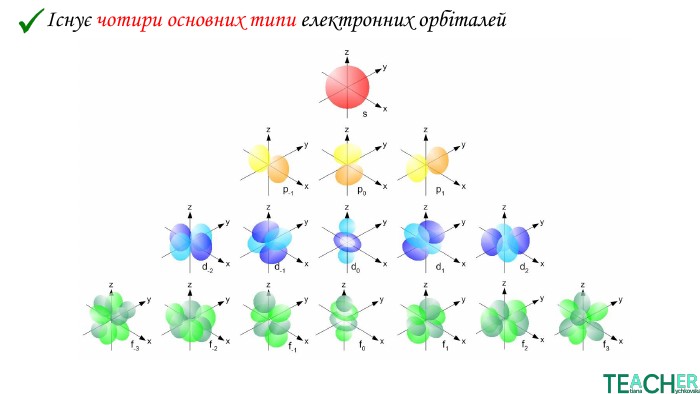
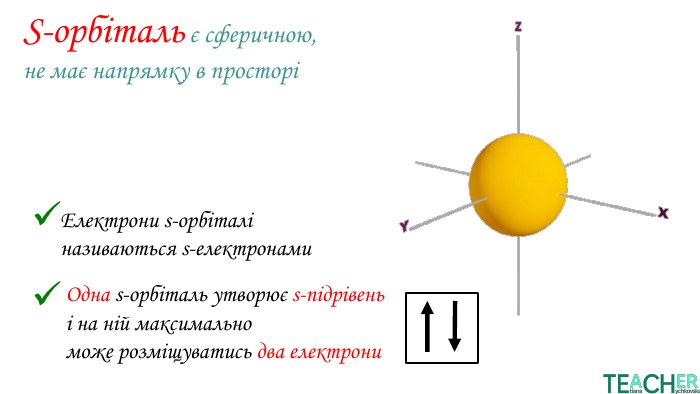
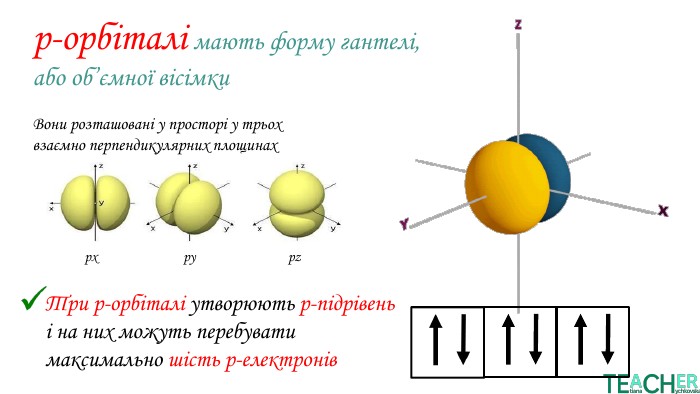
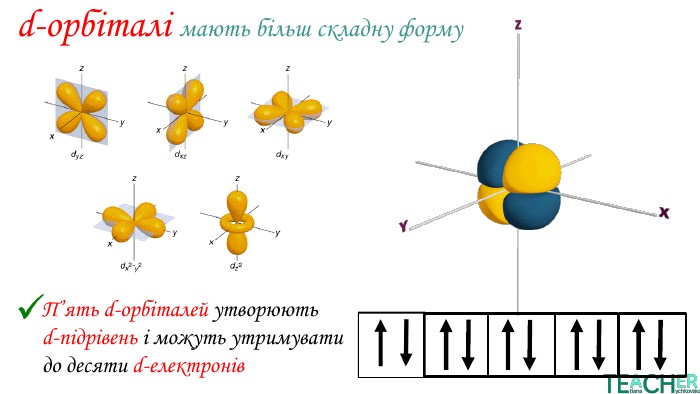
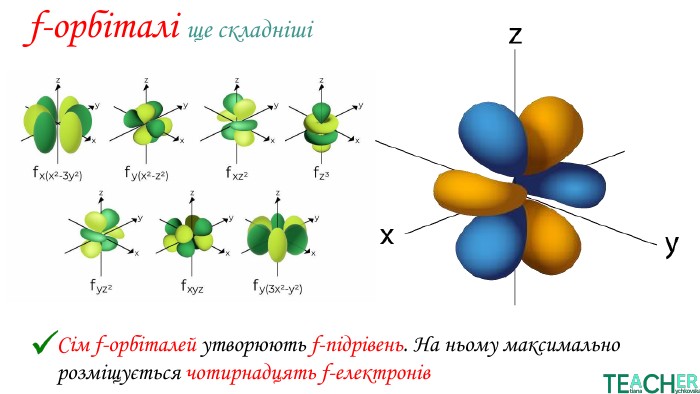
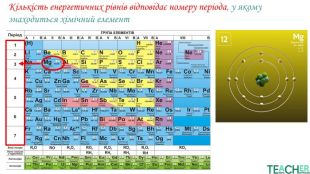
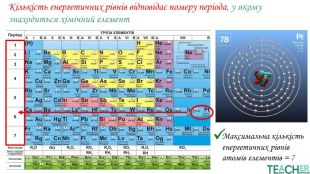
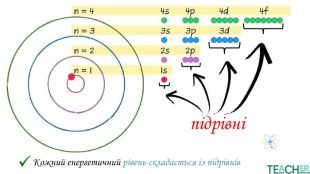
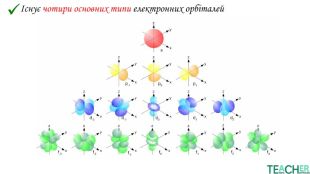
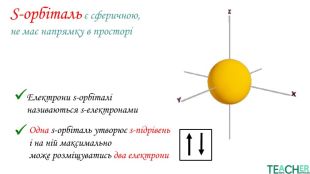
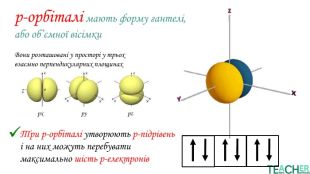
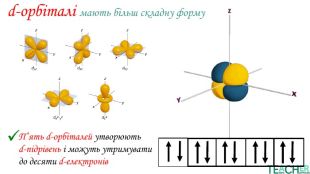
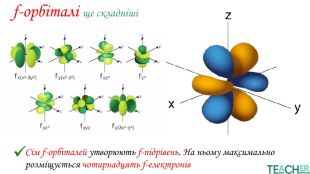
У презентації представлено матеріал про будову електронних оболонок, а саме, поняття енергетичного рівня, підрівня, електронної орбіталі, наведено форми орбіталей. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




















-

Павленко Тетяна Петрівна
21.10.2024 в 20:08
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Інна Євгенівна
26.09.2024 в 23:14
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Потапова Галина Іванівна
23.09.2024 в 18:44
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Орловська Наталія Вікторівна
01.10.2023 в 21:15
Тетяно Григорівно, дуже професійна робота !!! Дякую !!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пашаєва Тетяна Миколаївна
26.09.2023 в 18:17
Дуже дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука