Презентація до уроку з хімії для 10 - го класу "Карбонатна кислота. Карбонати і гідрогенкарбонати"
Дана робота - це мультимедійний супровід заняття на тему "Карбонатна кислота. Карбонати і гідрогенкарбонати". Презентація містить цікаві матеріали про поширеність карбонатної кислоти та її солей у природі, способи їх добування, властивості, галузі застосування. Презентація допоможе провести заняття на тему "Карбонатна кислота. Карбонати і гідрогенкарбонати".



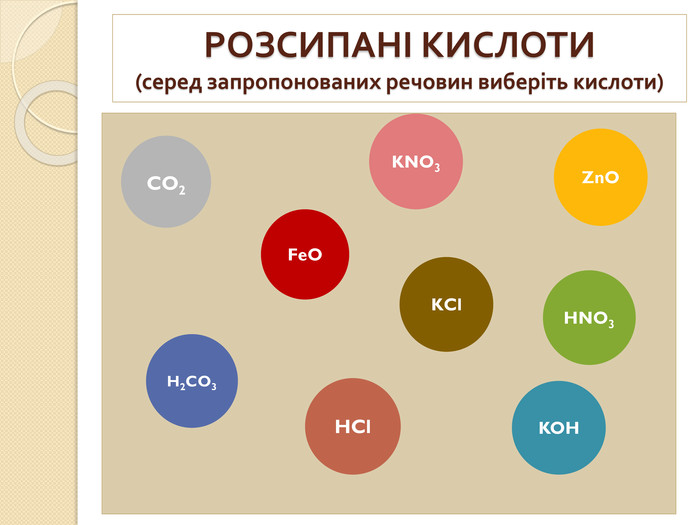
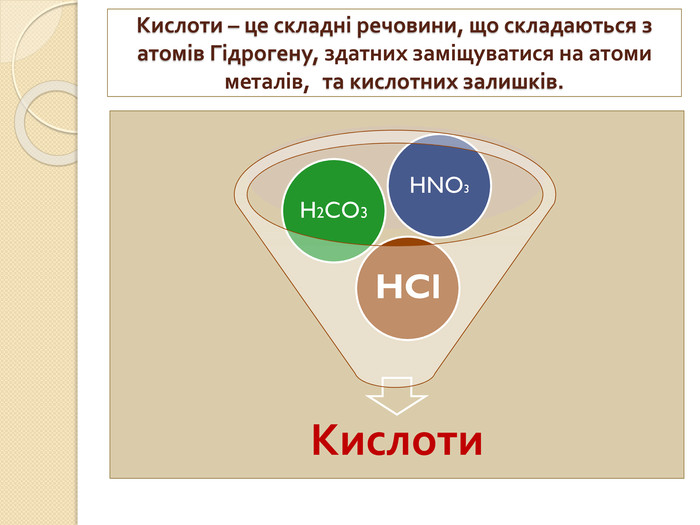








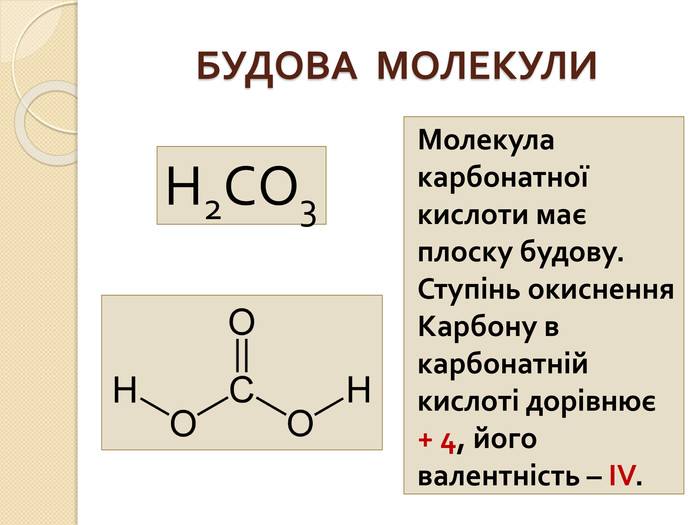
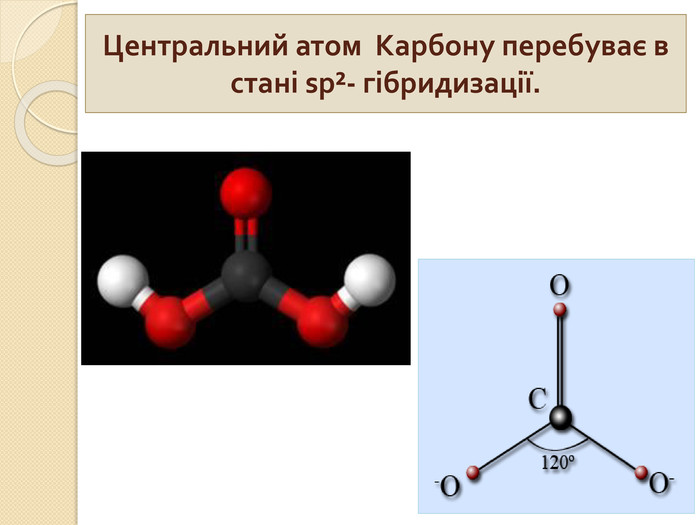
















































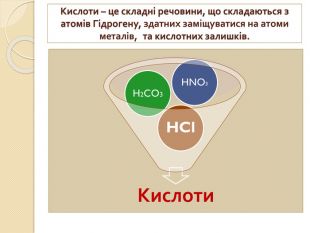
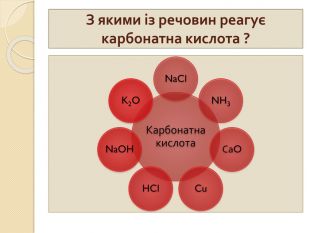
1. Які речовини називають кислотними оксидами?2. Які речовини називають індикаторами? 3. Що собою являють кислоти з точки зору електролітичної дисоціації? 4. Що таке основність кислоти? 5. Які кислоти називають оксигеновміс –ними?6. Як змінюється забарвлення індикато – рів у розчинах кислот?
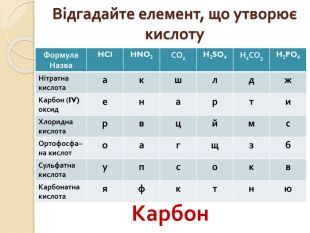
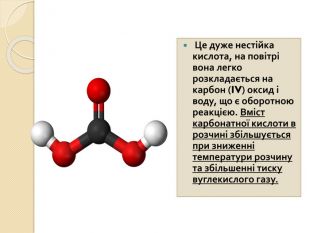
Відгадайте елемент, що утворює кислоту{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Формула. Назва. HCl. HNO3 СО2 H2 SO4 Н2 СО3 H3 PO4 Нітратнакислотаакшлдж. Карбон (IV)оксиденарти. Хлориднакислотарвцймс. Ортофосфа– на кислотоагщзб. Сульфатнакислотаупсокв. Карбонатнакислотаяфктню. Карбон
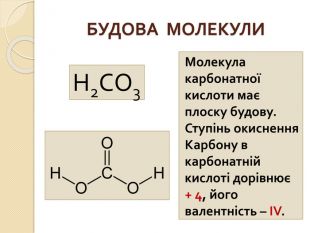
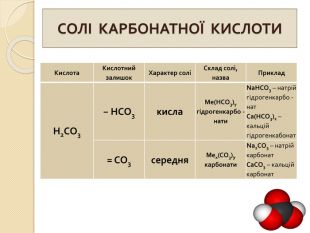
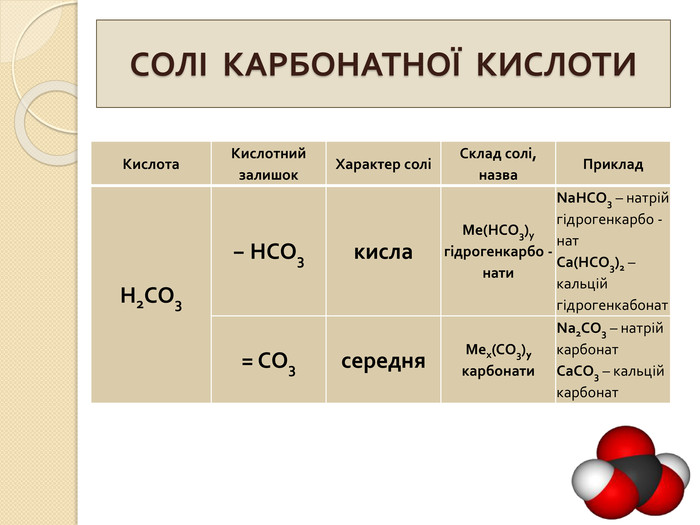
СОЛІ КАРБОНАТНОЇ КИСЛОТИ{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Кислота. Кислотний залишок. Характер соліСклад солі, назва. Приклад. Н2 СО3− НСО3кисла. Me(HCO3)угідрогенкарбо -нати. Na. HCO3 – натрій гідрогенкарбо -нат. Ca(HCO3)2 – кальцій гідрогенкабонат= СО3середня. Мех(СО3)yкарбонати. Na2 CO3 – натрій карбонат. Ca. CO3 – кальцій карбонат
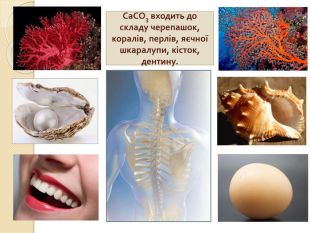
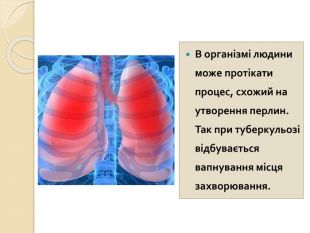
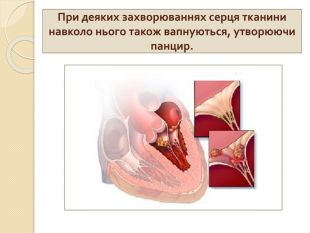
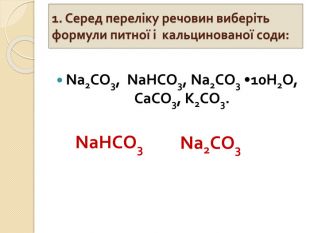
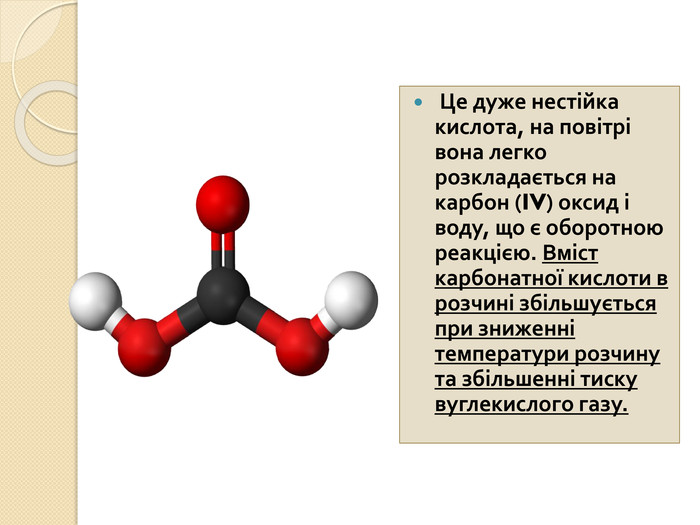
-
Шпильова Вікторія Володимирівна 13.02.2018 в 12:47Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку