"Конспект уроку з хімії для 10 класу на тему "Місце металічних елементів у періодичній системі, особливості будови їх атомів, металічний зв’язок. Фізичні властивості металів. Практ
Розробка уроку в 10 класі на тему "Місце металічних елементів у періодичній системі, особливості будови їх атомів, металічний зв'язок. Фізичні властивості металів. Практичне значення металів." Використовується на початку вивчення теми "Метали".
Тема: Місце металічних елементів у періодичній системі, особливості будови їх атомів, металічний зв’язок. Фізичні властивості металів. Практичне значення металів.
Мета:
Поглибити знання учнів про металічні елементи, їх розташування у періодичній системі, загальні фізичні властивості металів, особливості будови атомів і речовин; розширити уявлення про види хімічного зв'язку за допомогою поняття про металічний хімічний зв'язок; показати вплив зв'язку на фізичні властивості речовин, утворених металічними елементами; ознайомити учнів з історією відкриття металічних елементів ; значенням металів у житті людини; сприяти формуванню інформаційної, самоосвітньої, пізнавальної, інтелектуальної компетентностей учнів.
Розвивати в учнів компетентності, які допомагають саморозвитку, соціальну,полікультурну, комунікативну.
Тип уроку: засвоєння нових знань.
Форми роботи: індивідуальна, групова, фронтальна.
Методи: лекція, евристичнабесіда, робота з підручником,робота з картками самоконтролю, захист проектів, розв’язок хімічного кросворду, брейн-ринг,
Обладнання: періодична система хімічних елементів Д.І. Менделєєва, ряд активності металів, презентація до уроку; презентації учнів на теми: «Фізичні властивості металів», «Історія відкриття металів».
Очікувані результати:
Після уроку учні повинні:
знати: розташування металічних елементів у періодичній системі хімічних елементів, особливості будови атомів металічних елементів, будову кристалічної ґратки металів, утворення металічного зв'язку, загальні фізичні властивості металів, поширення металічних елементів у природі;
уміти: складати схеми будови атомів металів, пов'язувати будову металів з їхніми фізичними властивостями.
Хід уроку
І. Організаційний момент.
Привітання, перевірка присутніх та готовності учнів до заняття. Створення позитивного емоційного настрою учнів.
Емоційна рефлексія
Станьте в коло, протягніть уперед ліву руку й уявіть на ній усі ваші життєві знання. Протягніть уперед праву руку й уявіть на ній знання, з якими ви прийшли на сьогоднішній урок. Тепер з’єднайте руки. Так ваш життєвий досвід і спеціальні знання, об’єднані разом, сьогодні стануть у нагоді вам на уроці. А тепер візьміться всі за руки – так ви об'єднаєте знання кожного з вас для роботи на уроці й у групах.
ІІ. Мотивація навчальної діяльності
Учитель. Епіграфом сьогоднішнього уроку є слова Дмитра Івановича Менделєєва про працю: «Шлях до розвитку і, врешті – решт, до щастя людини пролягає через її працю». (слайд 1)
Не було б у світі великих гарних міст, струнких хмарочосів, якби не наполеглива праця винахідників,інженерів та робітників. Природа дарує людині воду, землю, каміння, залізну руду, але тільки праця здатна перетворити їх на речі складніші, цивілізовані. Без праці ми не могли би пересуватися за допомогою літаків, пароплавів, машин. Та що там – навіть колесо не придумали б, не доклавши зусиль. Праця все може – за її допомогою перемагають труднощі, знаходять рішення проблем, які здавалися тупиками, досягають добробуту. Праця насправді творить, удосконалює людину, а людина – про це казали мислителі всіх часів – за своєю природою жадає вдосконалення.
Тому, діти, нам потрібно гарно попрацювати, адже лише ту роботу, яка приносить людям користь, можна назвати працею. Тому я бажаю вам успіху сьогодні та позитивних емоцій на шляху до досягнення своєї мети. Ну що ж почнімо!
Діти, знання, які ви отримаєте сьогодні на уроці, будуть потрібні вам упродовж усього життя.
Адже
Всім відомо, без металу
Все на світі би стояло.
Не літали б літаки і космічні кораблі,
Якщо б не було титану,
Цього міцного металу.
Алюміній, цинк, свинець,
Всі потрібні людям.
Хаос буде на землі,
Якщо їх не буде!
Посуд зник тоді б у нас,
Не було б тоді прикрас
З золота і срібла.
Всі машини би стояли,
Прилади б не працювали.
ІІІ. Оголошення теми та мети уроку
Отже, сьогодні на уроці ми будемо вивчати місце металічних елементів у періодичній системі, особливості будови атомів, металічний зв’язок. Фізичні властивості металів. Практичне значення металів. (запис теми в робочі зошити). ( слайд 2) Мета уроку (слайд 3)
Досягати позитивного результату ми будемо за таким планом:
1.Історія відкриття металів.
2. Розташування хімічних елементів у періодичній системі.
3. Будова атомів металічних елементів.
4.Металічний зв'язок і металічні кристалічні ґратки.
5. Загальні фізичні властивості металів. (слайд 4)
6.Метали в організмі людини.
7.Метали в народній творчості.
Сьогодні до нас на урок із захистами своїх проектів завітають історики, фізики,філологи, біологи. Отже, перше слово історикам. З чого все починалося? Коли вперше людство почало використовувати метали?
ІV. Сприйняття й усвідомлення учнями нового матеріалу
1. Історія відкриття металів. ( захист учнівського проекту)
2. Розташування хімічних елементів у періодичній системі (слайд 5)
В одній країні під назвою Хімляндія в місті Періодична система жили-були Метали . Проживали Метали на лівому березі річки Діагональна, яка ділила місто на дві частини. В залежності від положення яке метали займали, вони носили одяг різного кольору. Активні, вибухонебезпечні метали, які проживали на вулицях Лужній та Лужноземельній носили одяг червоного кольору. Спокійні та врівноважені метали, які проживали на вулиці Побічній носили одяг синього кольору. Найнебезпечнішими вулицями в місті були Лантаноїдна та Актиноїдна де проживали шкідливі та радіоактивні метали, які одягалися в сірий колір. Такі законодавці моди як Індій, Талій, Станум, Плюмбум, Стибій, Полоній та Астат полюбляли яскравий жовтий колір. Метали були щирими, доброзичливими подільчивими. Цим користувалися Неметали,які проживали на правому березі річки. Вони були дуже жадібні і завжди позичали електрони у неметалів. Але Метали на них не ображались навіть дружили з ними і продуктом їх дружби були корисні і потрібні солі.Ну а тепер від казки переходимо до реальності.
Індивідуально-пошукова робота з підручником та періодичною системою хімічних елементів Д.І.Менделєєва.
Подивіться на періодичну систему хімічних елементів й визначте елементи12 і 54.
Це металічні чи неметалічні елементи? В яких періодах,групах та підгрупах вони розміщені? Давайте згадаємо,як змінюються металічні властивості елементів по періодах, групах. (слайд 6, 7)
Робота з картками самоконтролю-виконати завдання 1а)б)(додаток 1)
3. Будова атомів металічних елементів
Робота біля дошки (три учні)
1) Запишіть електронні конфігурації атомів кількох металів. Знайдіть, що є спільного?
11Na 1S22S22P63S1; 12Mg 1S22S22P63S2;
13Al 1S22S22P63S23Р1.
Висновок:
- На зовнішньому енергетичному рівні знаходиться невелике число електронів (звичайно 1 – 3).
- Радіуси атомів металів великі, порівняно з радіусами атомів неметалів того ж періоду.
2) Метали мають невелику електронегативність, тому легко віддають валентні електрони, тим виявляють відновні властивості. Здатність атомів металічних елементів втрачати електрони зростає зі збільшенням радіусів атомів: у періоді – справа наліво, а вгрупі згори до низу. (слайд 8)
Na – 1e- → Na+ (11Na+ 1S22S22P63So)
Mg – 2e- → Mg2+ (12Mg+ 1S22S22P63So)
АІ – 3e- → АІ3+ (13АІ+ 1S22S22P63So)
Робота з картками самоконтролю-виконати завдання 2.
4. Металічний зв’язок та металічні кристалічні гратки.
Саме здатність металів легко віддавати електрони і зумовила існування в них особливого типу хімічного зв’язку – металічного. Коли метали віддають електрони, вони перетворюються на позитивно заряджені йони –катіони,а віддані електрони починають хаотично рухатися у речовині. Ці електрони називають делокалізованими, або усуспільненими.
Отже,металічний зв’язок - це зв'язок між наявними в металах усуспільненими електронами, катіонами й атомами, у яких зберігся зв'язок валентних електронів із ядром.(слайд 9)
Давай те пригадаємо, які ще типи хімічних зв’язків вам відомі?
За рахунок чого утворюються ці типи зв’язків ?
Якщо для металів характерний металічний зв’язок то і кристалічну гратку вони мають також металічну. У вузлах цих граток розміщені позитивно заряджені електрони та нейтральні атоми, між якими вільно рухаються усуспільнені електрони. За рахунок вільного руху електронів метали проводять електричний струм і тепло.
Існує кілька типів металічних кристалічних граток:об’ємноцентрована кубічна; для різних кристалічних граток: а – об’ємноцентрована кубічна у натрію ; б – гранецентрована кубічнау алюмінію;в – гексагональна щільноупакована у магнію. (слайд 10)
Які ще типи кристалічних граток вам відомі?
Що знаходиться у вузлах цих граток?
Робота з картками самоконтролю-виконати завдання 3а)б)
5. Фізичні властивості металів(захист учнівського проекту-презентація).
Робота з картками самоконтролю-виконати завдання 4.
Вправа «Шерлок Холмс» (слайд11)
А тепер групи виконають роль Шерлока Холмса: потрібно розглянути кримінальну справу.
До нас надійшла телеграма з міліції: «Метал, подібний за своєю валентністю до Магнію і Кальцію, упав у кислоту. Цей метал масою 26г витіснив із хлоридної кислоти водень кількістю речовини 0,4моль. Просимо встановити прізвище металу. Слідчий Катіоненко.» Отримайте матеріали справи, яка група швидше віднайде зниклого (роздати умову задачі групам – хто швидше розв’яже задачу)
А ще я хочу доручити цю справу експерту, який буде розв’язувати задачу самостійно, в секреті від інших. Це …
5.Метали в організмі людини (захист учнівського проекту-публікація).
6.Метали в народній творчості ( приказки, прислів’я, загадки прометали ) – виступ групи філологів.
ІV. Закріплення і узагальнення знань
Брейн – ринг
1. Скільки електронів мають метали на зовнішньому енергетичному рівні?
(1-3)
2. Яку кристалічну ґратку мають метали? (металічну)
3. Які частинки лежать у вузлах ґратки? (катіони металу)
4. Який метал має найбільшу електропровідність? (Ag)
5. Який метал має найбільший блиск? (Ag)
6. Який метал можна розплавити на руці? (t пл. Cs =28,5°C, tпл.Ga =29,7°C)
7. Які ви знаєте порівняння , де застосовуються назви металів?
Золоте серце
Золоті руки
Міцний як криця
Залізна воля
Залізний характер
Сивина як срібло
Швидкий, як ртуть
8. Які метали є в складі різних органів людини?
Са – в кістках, Сu – в печінці, Mn – в серці, Zn – в зубах, Fe – в крові,Au – в крові.
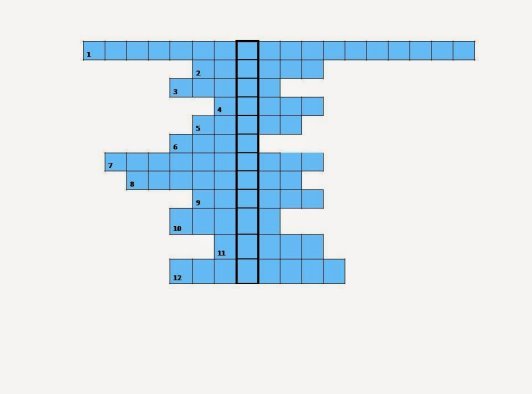
Хімічний кросворд (назвати ключове слово) додаток 2 (слайд 12,13)
1.Одна із найважливіших фізичних властивостей металів (електропровідність).
2. Який метал має найбільшу пластичність? (Au)
3. Твердий розчин одного металу в іншому (сплав)
4. Найважчий з металів? (Os)
5. Найлегший з металів? (Lі)
6. Які частинки лежать у вузлах металічної ґратки? (катіони)
7. Особливий тип хімічного зв’язку, властивий металам та їхнім сплавам
(металічний)
8. Метал, що характеризується легкістю, високими електропровідністю та теплопровідністю, пластичністю, широко застосовується в побуті і промисловості (Al)
9. Метал, що за електропровідністю стоїть на першому місці, має сильний металічний блиск (Ag)
10. Фізична властивість металів, що зумовлена здатністю відбивати світлові промені (блиск)
11. Який метал найбільш легкоплавкий? (Hg)
12. Який метал найбільш тугоплавкий? (W)
V. Підбиття підсумків уроку
Дякую, діти. Ви гарно сьогодні попрацювали і тому спробуємо разом оцінити вашу роботу на уроці. Спочатку ви попрацюйте з картками самооцінки, виставте бали за роботу в групі і підрахуйте загальну кількість балів (з врахуванням бонусів), яку ви поставите собі за урок. А потім вашу роботу оціню я.
Оцінювання учнем власної участі у роботі
«Оціни свій успіх»
Прізвище, ім’я _______________________________________
Оцініть себе за кожним із визначених напрямів від 0 до 2 балів.
1. Ви брали активну участь у роботі групи ____________________
2. Ви вносили вдалі пропозиції, які група брала до уваги _______
3. Ви надавали підтримку іншим членам групи, заохочували їх до роботи___
4. Ви доповідали класу про результати групової роботи __________
5. Бонус ( «Шерлок Холмс», брейн – ринг, хімічний кросворд) максимально по 3 бали за кожне завдання__________________________________________
6.Результати картки самоконтролю_______________
Усього балів _________________________________
Виставлення оцінок. Поки я буду виставляти вам оцінки, відкрийте щоденники і запишіть домашнє завдання.
Домашнє завдання: (слайд 14) Прочитати параграф 17 розв’язати вправу164, ст.123, прочитати ст.124 для допитливих, скласти ребуси до теми.
Рефлексія
Усе має свій початок і кінець… Завершується і наш урок, на якому ви збагатилися новими знаннями і, сподіваюся, він залишив у душі кожного з вас певні враження. Мені дуже сподобалось, як ви творчо, активно працювали. А ваші враження?
Чи досягли ми мети, поставленої на початку уроку? Чи дізналися ви щось нове для вас ? Чи будете ви використовувати знання отримані сьогодні на уроці в повсякденному житті? Чи отримали ви задоволення від нашого уроку?
Якщо ваша відповідь «так», то приклейте зелений стікер у формі пробірки на штатив, що розміщений на нашій дошці. Якщо – «ні», то рожевий.
Отже, зелений - колір надії на те, що знання, отримані сьогодні на уроці, згодяться вам у майбутньому.
Картки самооцінки залишаються вам на згадку. Хай вони будуть свідченням вашого успіху на уроці, якщо ви оцінили себе на високий рівень або слугують стимулом для більш активної діяльності у майбутньому.
Картка самоконтролю.
Завдання 1а. Місце елементів-металів у періодичній системі.(2 б.)
а) Гра “Третій зайвий” Підкресліть символ елемента, властивості якого відрізняються від властивостей двох інших, вкажіть ознаку за якою він відрізняється:
1) Nа, Р, Аl 3) Мо (молібден), Та (тантал), Li
2) С, К, Мg 4) Оs (осмій), Аs (арсен) , Сd (кадмій)
Завдання 1б. Місце елементів-металів у періодичній системі.Впишіть пропущені слова в текст:(2 б)
До металів належать усі елементи головних підгруп, що знаходяться _________ діагоналі _______. До металів належать також усі елементи _________ підгруп. По періоду металічні властивості _____________,а по групі____________.
Завдання 2. Особливості будови атомів металів. Скласти електронні формули елементів під № 19 та 30.Вкажіть кількість електронів на зовнішньому рівні даних металів.(2 б)
Завдання 3. Металічний зв’язок металічні гратки. Підпишіть частинки:(2 б)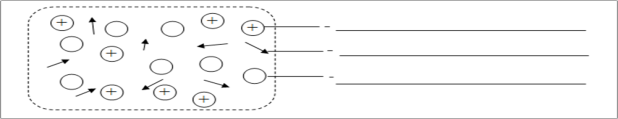
Впишіть в таблицю особливості утворення металічного зв’язку:(2 б)
|
Тип зв’язку |
Ковалентний |
Йонний |
Металічний |
|
За рахунок чого утворюється |
|
|
|
Завдання 4. Загальні фізичні властивості металів.(2 б)
З переліку властивостей речовин підкресліть ті, які є характерними для металів:газоподібні речовини; тверді речовини; рідини; без кольору; мають металічний блиск; сріблясті або жовтуваті; діелектрики; тепло- та електропровідні; крихкі; пластичні; як правило добре розчиняються у воді; міцні.
Хімічний кросворд
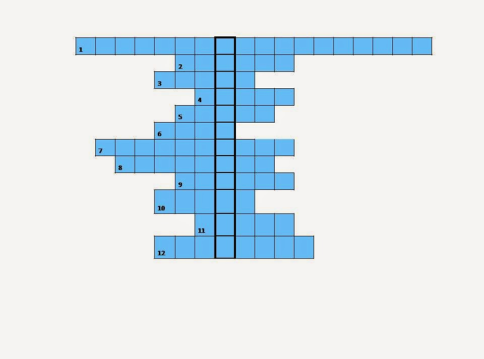
1.Одна із найважливіших фізичних властивостей металів
2. Який метал має найбільшу пластичність?
3. Твердий розчин одного металу в іншому
4. Найважчий з металів?
5. Найлегший з металів?
6. Які частинки лежать у вузлах металічної ґратки?
7. Особливий тип хімічного зв’язку, властивий металам та їхнім сплавам
8. Метал, що характеризується легкістю, високими електропровідністю та теплопровідністю, пластичністю, широко застосовується в побуті і промисловості
9. Метал, що за електропровідністю стоїть на першому місці, має сильний металічний блиск
10. Фізична властивість металів, що зумовлена здатністю відбивати світлові промені
11. Який метал найбільш легкоплавкий? 12. Який метал найбільш тугоплавкий?
«Оціни свій успіх»
Прізвище, ім’я _______________________________________
Оцініть себе за кожним із визначених напрямів від 0 до 2 балів.
1. Ви брали активну участь у роботі групи ____________________
2. Ви вносили вдалі пропозиції, які група брала до уваги _______
3. Ви надавали підтримку іншим членам групи, заохочували їх до роботи___
4. Ви доповідали класу про результати групової роботи __________
5. Бонус ( «Шерлок Холмс», брейн – ринг, хімічний кросворд.) максимально 3 бали за кожне завдання__________________________________________
6. Результати картки самоконтролю__________
Усього балів _________________________________
13-15 б.- 7
16-18 б.- 8
19-21 б- 9
22-24 б.- 10
25-27 б.- 11
28 і вище - 12


про публікацію авторської розробки
Додати розробку