Конспект уроку з хімії для 10-го класу на тему: "Хімічні властивості металів"
Конспект уроку з хімії для 10-го класу на тему: "Хімічні властивості металів"
Мета: Розглянути хімічні властивості металів як простих речовин з позиції знань про окисно – відновні реакції і витиску вальній ряд металів, усвідомити хімічну функцію металів, як відновників. Сформувати уміння порівнювати хімічну активність металів на прикладі взаємодії з водою, кислотами, солями, уміти складати хімічні рівняння, дотримуватись правил техніки безпеки при виконанні лабораторних робіт.
Тип уроку: набуття нових знань, формування навичок.
Форма уроку: урок-гра «Засідання Рядів Металів»
Обладнання: таблиці – фракція «Активні метали», фракція «Перехідні метали», фракція «Незалежні метали», таблиця знаків «Хімічні елементи»
ТЕМА: ХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ
Мета: Розглянути хімічні властивості металів як простих речовин з позиції знань про окисно – відновні реакції і витиску вальній ряд металів, усвідомити хімічну функцію металів, як відновників. Сформувати уміння порівнювати хімічну активність металів на прикладі взаємодії з водою, кислотами, солями, уміти складати хімічні рівняння, дотримуватись правил техніки безпеки при виконанні лабораторних робіт.
Тип уроку: набуття нових знань, формування навичок.
Форма уроку: урок-гра «Засідання Рядів Металів»
Обладнання: таблиці – фракція «Активні метали», фракція «Перехідні метали», фракція «Незалежні метали», таблиця знаків «Хімічні елементи»
Реактиви: розчин – HCl, CuSO4, FeSO4, Al(SO4)3; метали - Mg, Na, Zn, Fe Cu, індикатори, пробірки, вода.
Химическим свойством металлов
Урок мы сейчас посвятим.
Учиться мы все не устали
Больше узнать мы хотим.
Хід уроку
1.Організаційна частина
2. Мотивація
Метали та їх сплави широко використовуються у народному господарстві. Щоб правильно їх використовувати наслідки їх перетворень. Тому сьогодні продовжимо знайомство з темо «Хімічні властивості металів»
Девіз уроку: Узагальнення спостережень дозволяє з’ясувати закономірності.
3. Повідомлення мети уроку.
З’ясувати з якими складними речовинами реагують метали. Формувати вміння прогнозувати можливість реакцій на підставі ряду активностей, складати хімічні рівняння, застосовувати метод електронного балансу.
Давайте визначимо, про що ми повинні дізнатися на уроці, що вміти.
Знати:
1.Хімічні властивості металів
2.Правила техніки безпеки при виконанні дослідів
Уміти:
Складати рівняння хімічних реакцій, спостерігати, аналізувати, порівнювати, користуватись рядом активностей металів, висловлювати і доводити свою точку зору.
4. Вивчення нового матеріалу.
Шановні гості, учні, уявіть собі що ми з Вами знаходимось в країні «Хімляндії» на засіданні «Ради Металів» , однією із палат Парламенту країни.
На сьогоднішньому засіданні присутні три фракції: фракція «Активних металів», фракція «Перехідних металів», фракція «Незалежних металів».
А які фракції відсутні? – лантаноїди і актиноїди перебувають за межами Парламенту. На порядку денному одне питання – з’ясування, як представники фракції «Ради металів» ставляться дло різних верств населення країни, а саме, доводи класу кислот, класу солей.
На попередньому уроці ми розглядали тему «Положення металів в періодичній системі, особливості будови, фізичні властивості, та відношення металів до простих речовин».
Тож давайте повторимо цей матеріал:
- Де в таблиці Менделєєва розміщені метали?
- Які особливості будови мають вони?
- Який тип зв’язку мають метали?
- Якими фізичними властивостями володіють метали?
- З якими простими речовинами взаємодіють метали?
В цей час активні метали сперечаються і порушують дисципліну. Я роблю їм зауваження і звертаю увагу на те, що Магній має під оком синець.
- Що трапилось?
Магній: Я посварився з Натрієм и Калієм. Вони доказують, що вони активніші, а я доводив, що Я! От вони і довели.
Вчитель: Шановні депутати! Давайте звернемося до таблиці Менделєєва і розв’яжемо це питання. Прошу пане Натрію, доведи свою активність.
Натрій: Я стою з магнієм в одному періоді, але мій знак знаходиться лівіше, ніж Магній. Ми пам’ятаємо, що в періоді активність зменшується з ліва на право.
Вчитель: Хто ще хоче мати слово?
Відповідають члени парламенту, доводять правоту.
Вчитель: Депутат Кальцій, ви докажіть свою активність.
Кальцій: Ми з Магнієм стоїмо в одній групі. На зовнішньому електронному рівні маємо однакову кількість електронів, але заряд ядра атому у нас різний, у мене більший. Ми пам’ятаємо, що у головних підгрупах активність зростає зверху вниз, тому я активніший.
Вчитель: А тепер, давайте подивимося, як метали кожної фракції відносяться до води.
Фракція «Активних металів» дослід з Натрієм демонструє разом з вчителем.
Фракція «Перехідні метали» проводить дослід взаємодії Цинку з Водою.
Фракція «Незалежні метали» - проводить реакцію Міді з Водою.
Робимо спостереження, аналізуємо, робимо висновки, складаємо рівняння реакції:
- 2Na+H2O = 2NaOH+ H2
- Zn+H20 = ZnO + H2
- Cu+H2O = …
Вчитель: Шановні Депутати! Для того, щоб доказати, як метали відносяться до «Країни солей» напередодні давалось завдання експертній групі. Надаємо їй слово.
Вони проводять досліди розчинів солей з металами – одержали наступний результат:
Fe + CuSO4 = FeSO4 + Cu
Cu + FeSO4 = …
2Al+3CuSO4 = Al2(SO4)3+3Cu
Cu+Al2(SO4)3= …
При поясненні цих дослідів звертаємось до ряду активності металів і робимо висновки.
Вчитель: і нарешті, шановні депутати, ви маєте унікальну можливість подивитися, як взаємодіють представники фракції з кислотами.
Все необхідне обладнання і реактиви у вас є на столах. Ви будете проводити реакції Цинку, Магнію і Міді з хлористою кислотою, тобто виконувати лабораторну роботу. Але перед цим, слово надаємо Депутату Аргентуму, який відповідає в парламенті за техніку безпеки.
Депутат з техніки безпеки: Я нагадую правила з техніки безпеки при роботі з кислотою. Підчас роботи з кислотами будьте обережні! Разом згадаємо правила і приступаємо до виконання лабораторної роботи.
Вчитель: Що ви спостерігали при взаємодії кислот з металами? Зробіть висновки, користуючись рядом активності металів. Складіть рівняння реакції.
Mg+2HCl=MgHl2+H2
Zn+2HCl = ZnCl2+H2
Cu+HCl= …

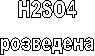
 Для закріплення виконуєм завдання «Квітка Семецвітка» усно, а рівняння – на домашнє завдання.
Для закріплення виконуєм завдання «Квітка Семецвітка» усно, а рівняння – на домашнє завдання.
![]()
![]()


![]()

![]()


![]()
![]()

![]()
Стук в двері. Принесли телеграму із міліції. Зачитую зміст телеграми.
«Метал, валентністю 2, масою 13 г, впав у Соляну кислоту і витіснив із неї Водень, кількість речовин 0,2 моль. Просимо негайно встановити прізвище металу и висловити йому співчуття.
Підпис, Слідчий Катіоненко »
Вчитель: давайте проведемо розслідування. Прошу Депутата Натрія до дошки. Складемо рівняння і зробимо розрахунок.
Me (13/Х гр ) + 2HCl = MeCl2+H2(0,2/1 моль)
13/X = 0,2/1 моль
Х = 65 гр (Zn)
Вчитель: Шаночні Депутати, жителів Нікольського району турбує питання про метал, який знайшли у цьому районі, це – Цирконій!
Люди зверталися до компетентних органів, виходили на мітинги, писали листи з проханням не добувати цей метал у нашому селищі.
Депутатам дали завдання вияснити, що являє собою цей метал і які міри прийняті сьогодні. (Депутати зачитують підготовлений проект за даним питанням)
А тепер до вашої уваги реклама про деякі метали (кожний депутат рекламує метал).
Вчитель: А більш детальніше за метали та їх значення ви можете узнати в газеті «В світі металів» та «У гостях у Валеології». І на згадку про наш урок творча група підготувала збірку загадок, віршів, вікторин про метали. І дарує їх вам.
5.Домашнє завдання
Параграф 18, п.1 . Скласти рівняння до завдання «Квітка-Самоцвітка» та задачу.
Королівський суд передав дії на додаткове розслідування «Невідомий трьохвалентний метал, масою 9 грам вночі прореагував з хлоридною кислотою і забрав кислотний залишок, зник в темряві. Переляканий водень кількістю речовини 0,5 моль ледве утримався на місті до приїзду оперативної групи, а потім вилетів геть. Який метал прореагував з кислотою?»
- Підсумок уроку

про публікацію авторської розробки
Додати розробку
