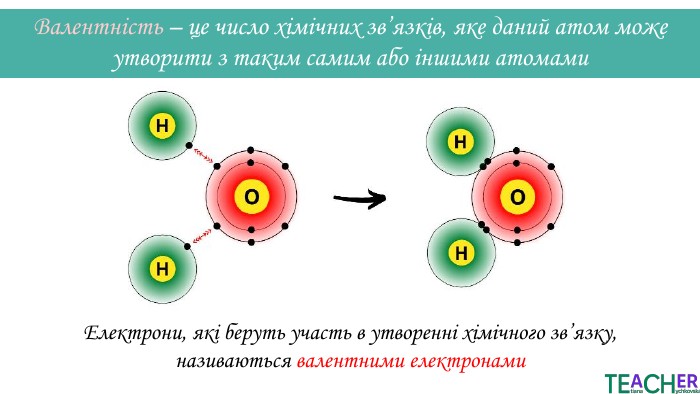
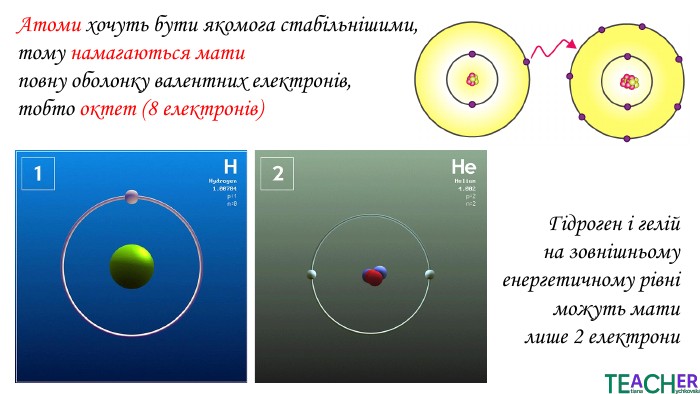
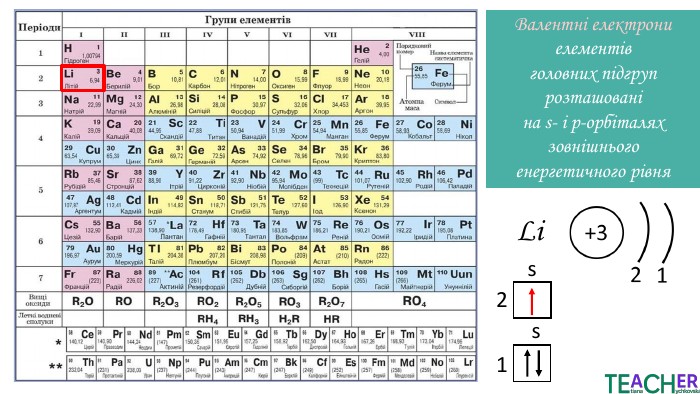
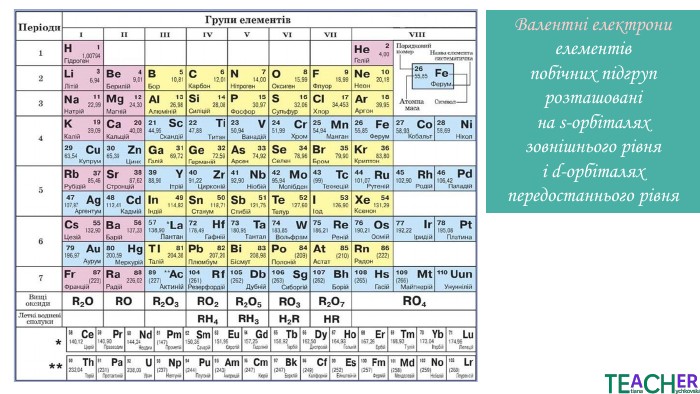
Презентація до уроку: "Збуджений стан атома. Вища валентність"
Про матеріал
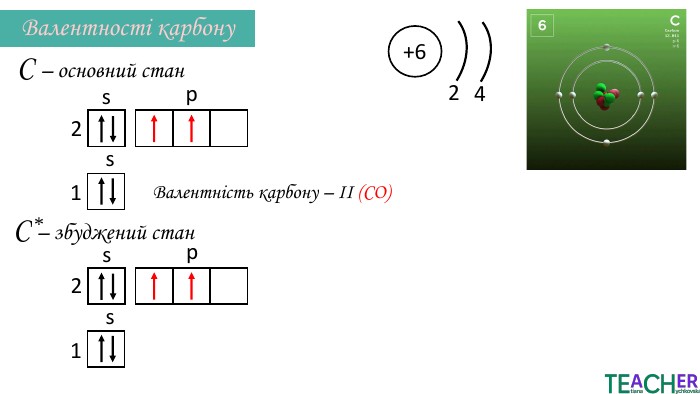
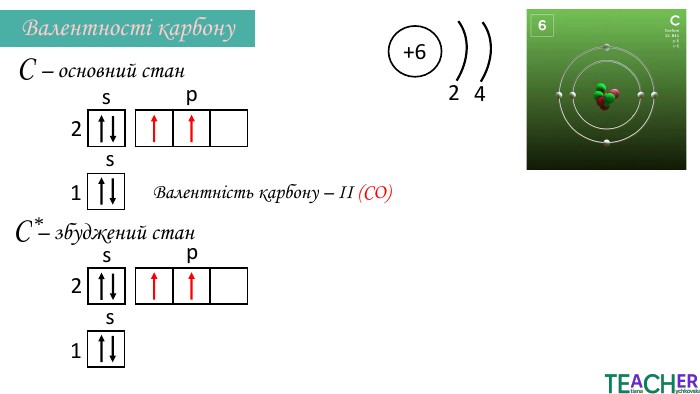
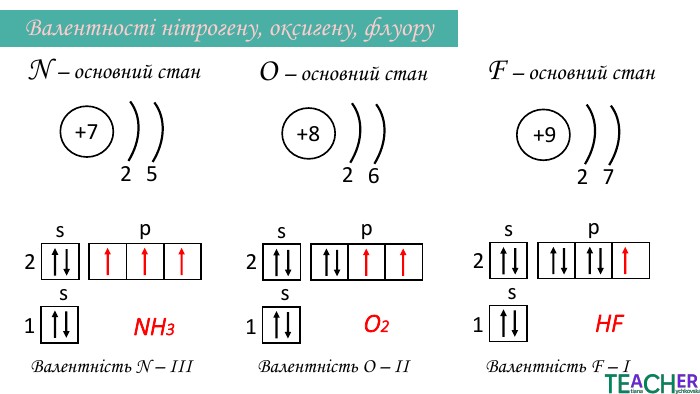
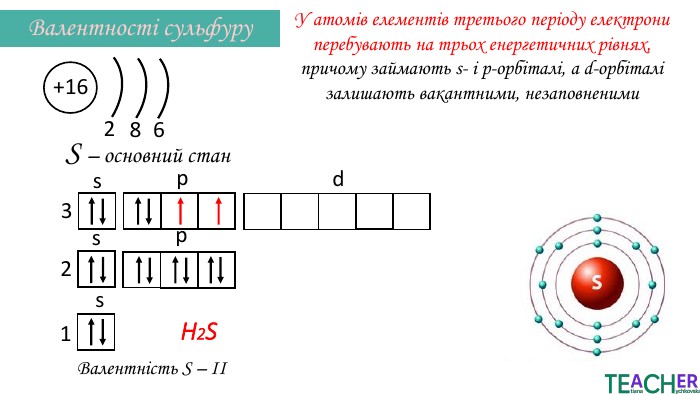
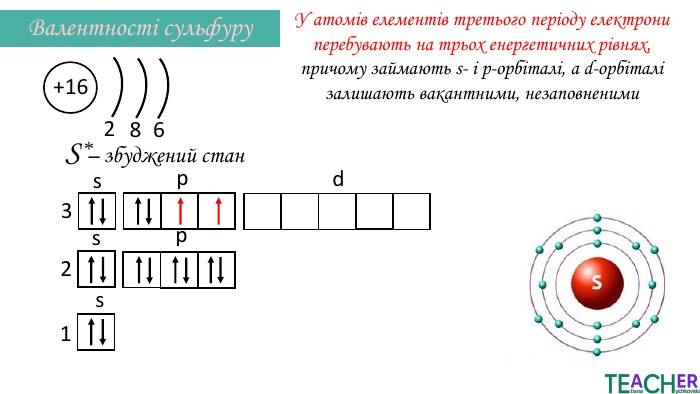
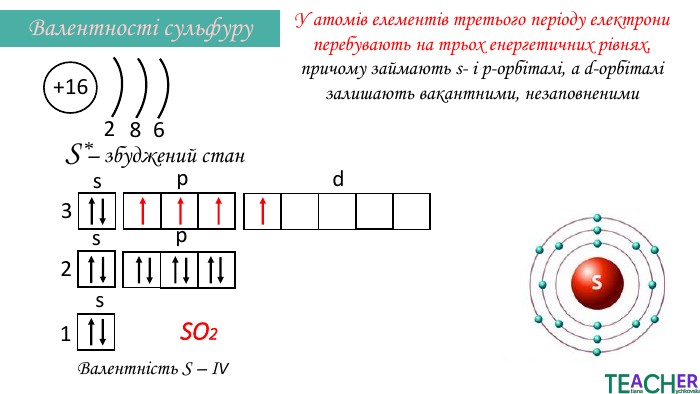
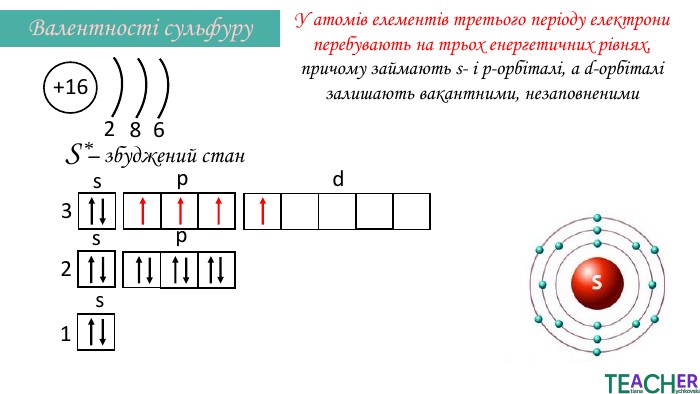
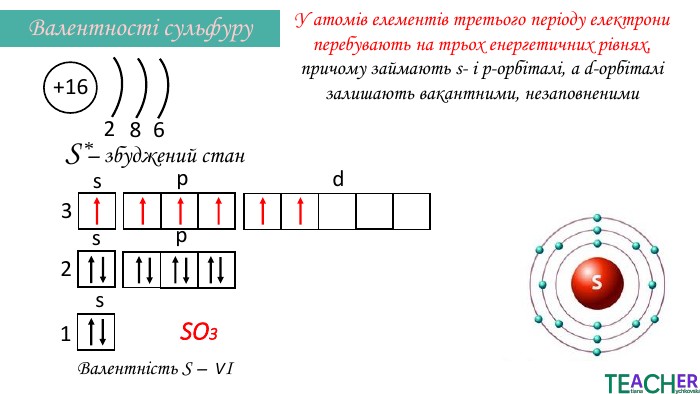
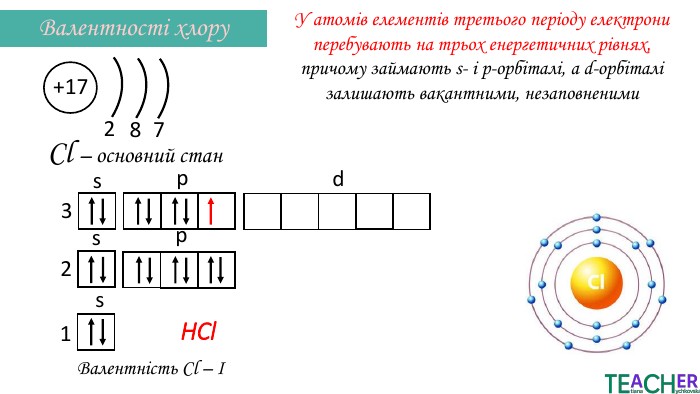
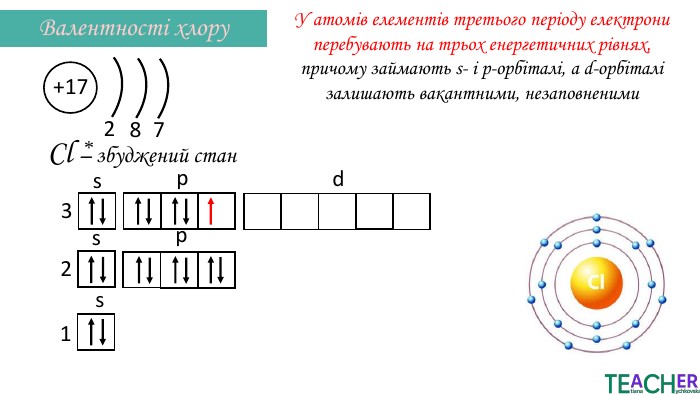
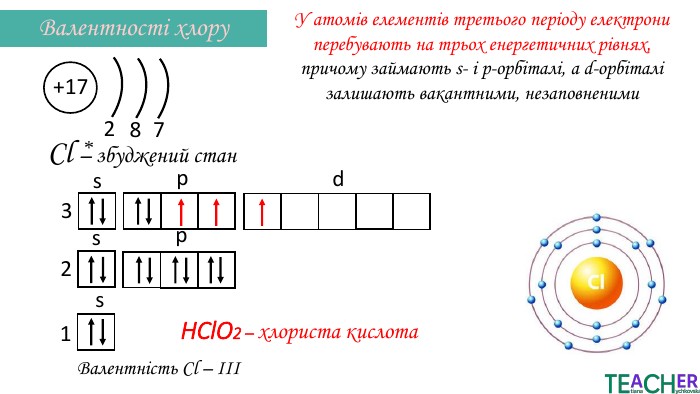
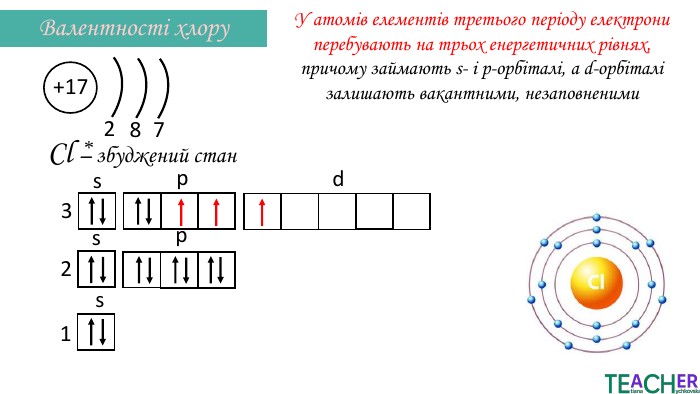
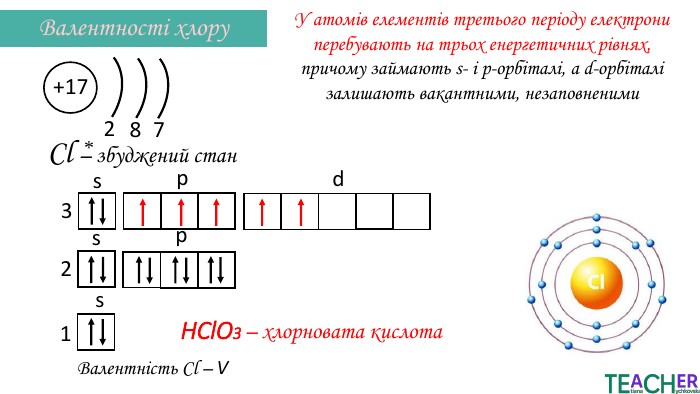
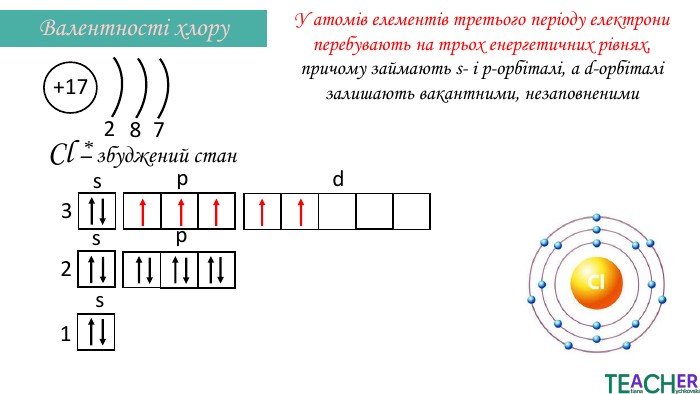
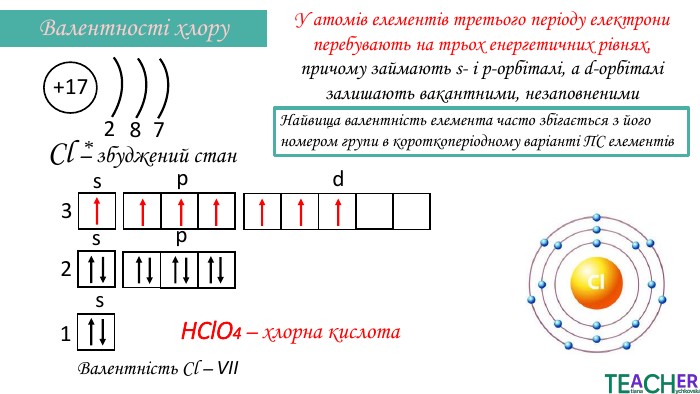
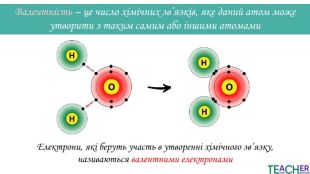
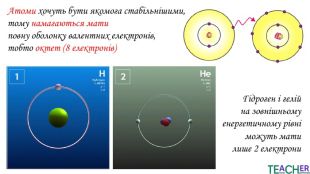
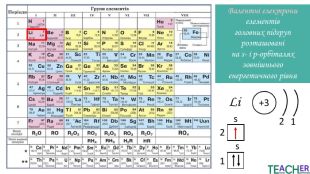
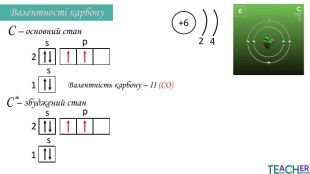
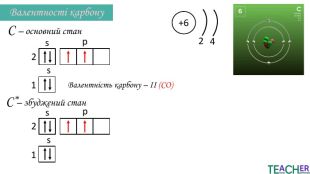
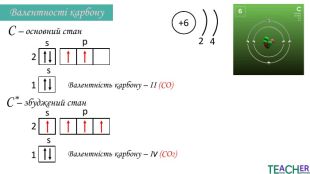
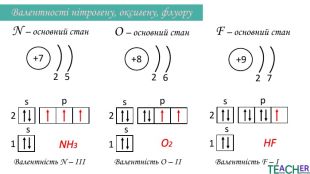
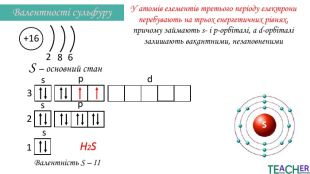
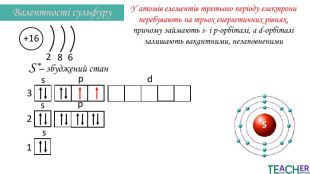
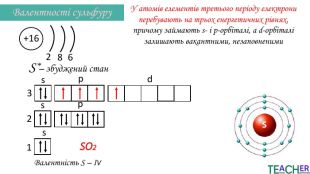
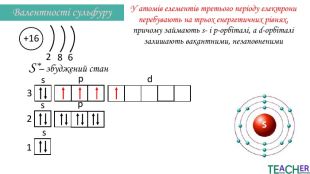
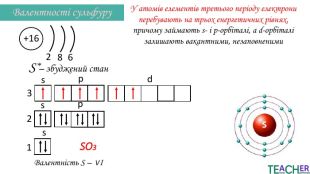
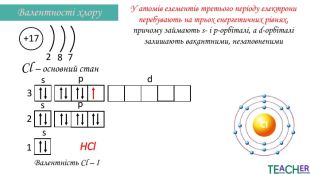
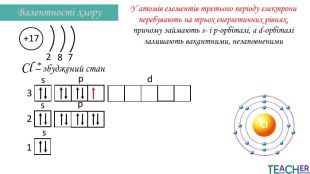
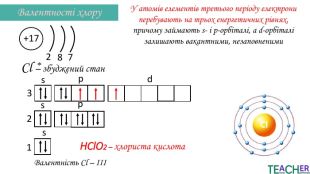
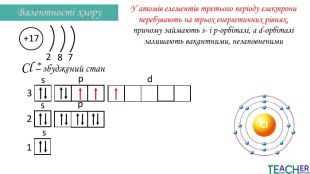
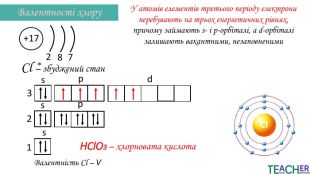
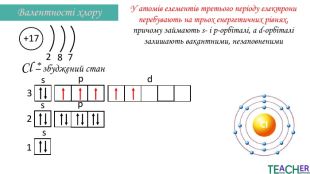
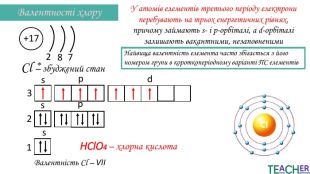
У презентації подано поняття збудженого стану атома, наведено механізм на різних прикладах. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!
-
Дуже вдячна!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку