Презентація « Добування ферум(II) та (III) гідроксидів, взаємодія їх з кислота» 9 клас
Про матеріал
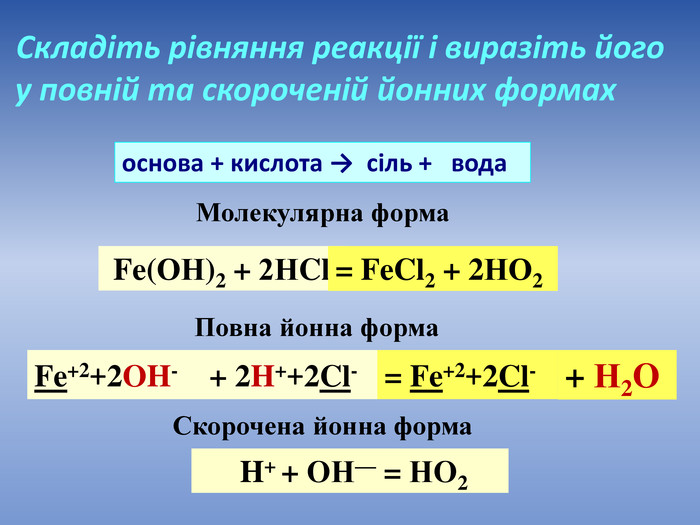
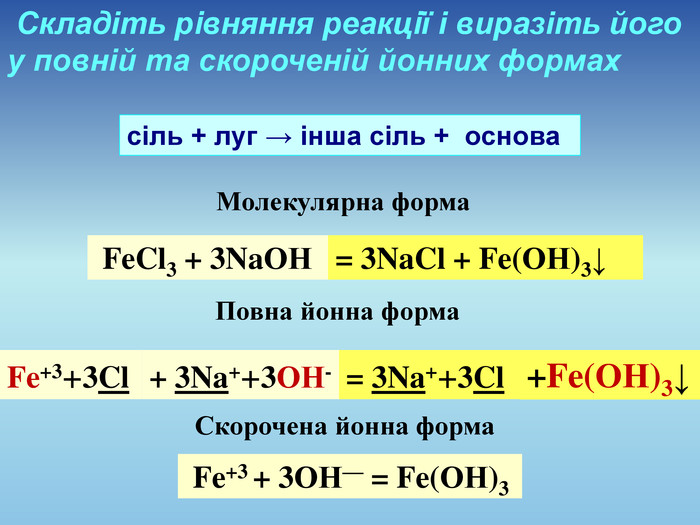
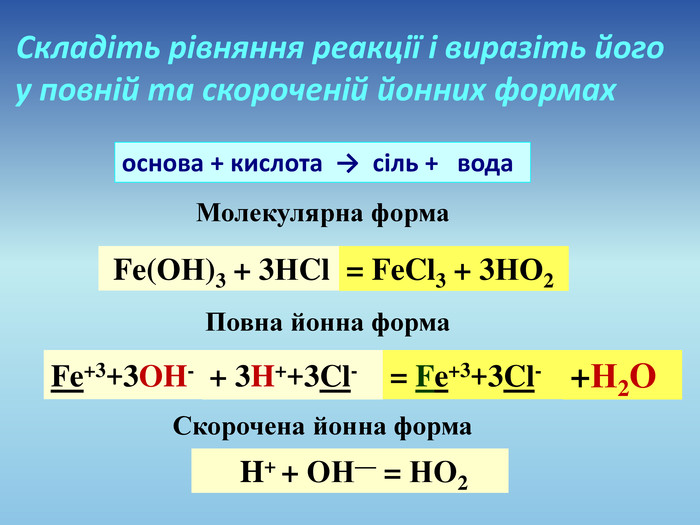
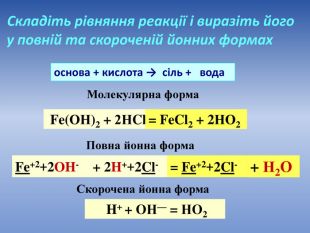
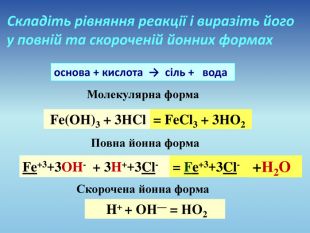
Презентація допоможе провести урок на тему «Реакції обміну між розчинами електролітів, умови їх перебігу. Йонно-молекулярні рівняння хімічних реакцій. Лабораторні досліди №4 «Реакції обміну між електролітами у водних розчинах, що супроводжуються випаданням осаду.»
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
По-перше: такої практичної роботи програмою не передбачено! По-друге: шановний вчителю, замість зарядів йонів у Вас показані ступені окиснення!!!!!! що НЕ допустимо! Виправте, будь ласка, помилки.
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку