Презентація: "Елекролітична дисоціація в розчинах електролітів"
Про матеріал
Презентація з теми "Елекролітична дисоціація в розчинах електролітів".
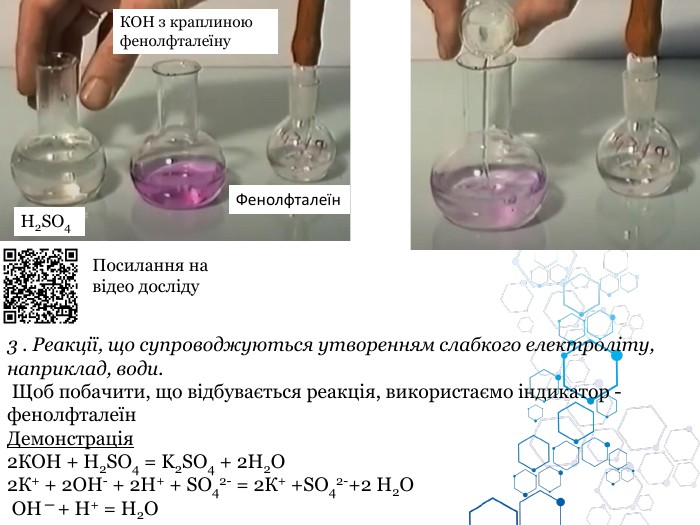
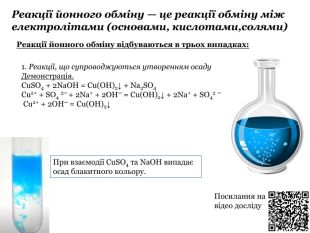
Містить навчальний матерал з теми, фото дослідів та qr-коди з посиланням на YouTube цих відео-дослідів.
Презентацію складено блоками та розбавлено картинками для кращого сприйняття матеріалу. Перегляд файлу
Зміст слайдів

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку