Презентація "Електролітична дисоціація"
Про матеріал
Презентація з хімії "Електролітична дисоціація".
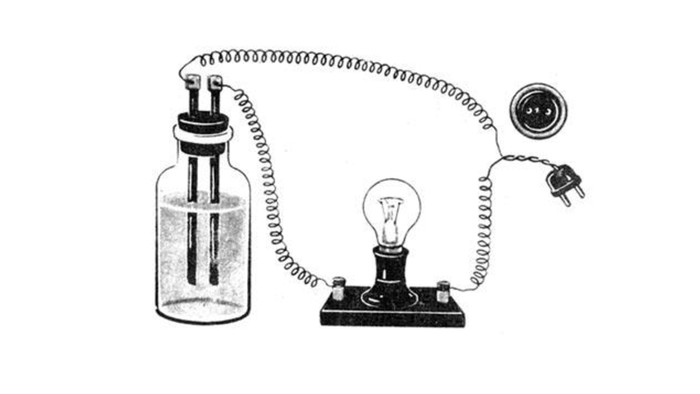
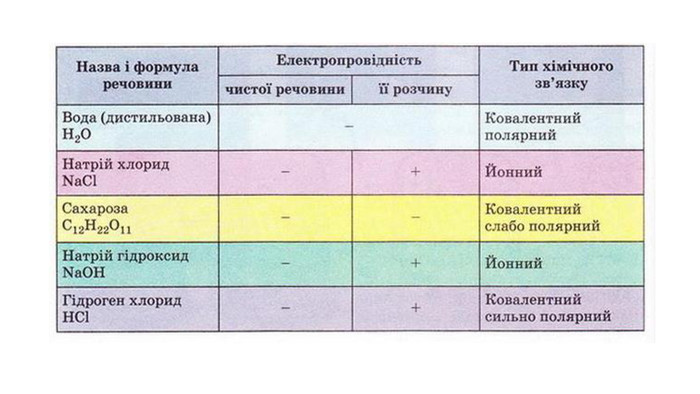
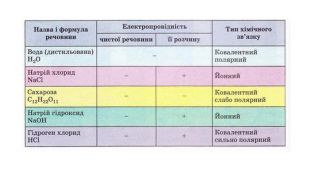
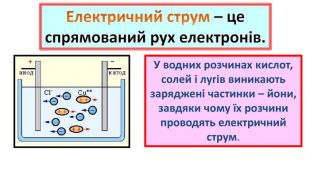
1. Електропровідність речовин
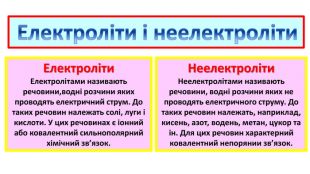
2.Електроліти та неелектроліти
3.М. Фарадей
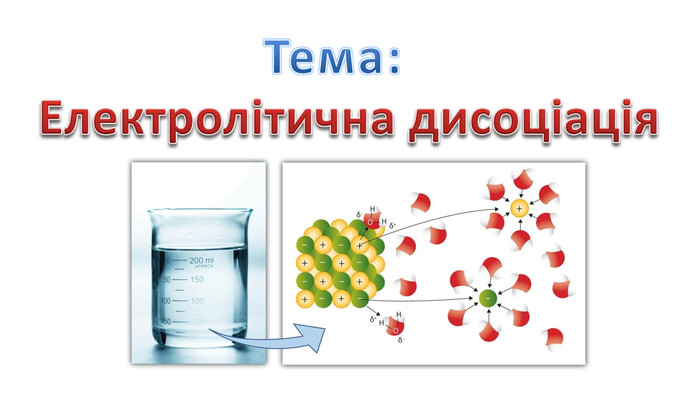
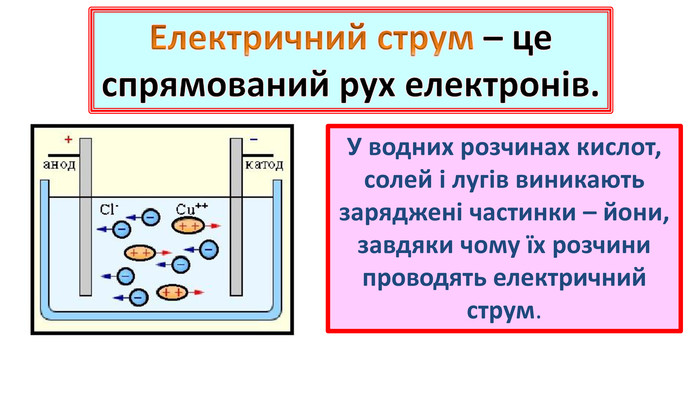
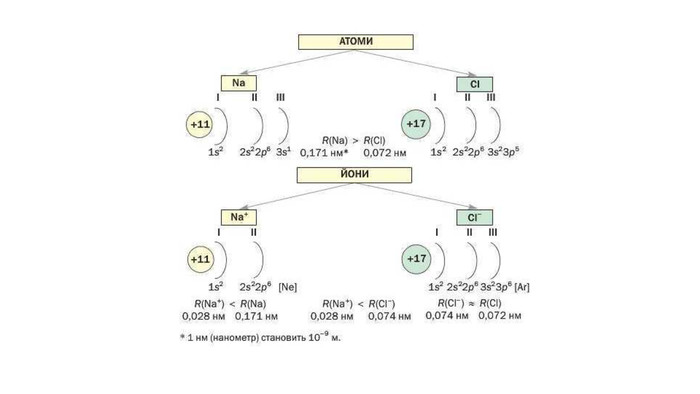
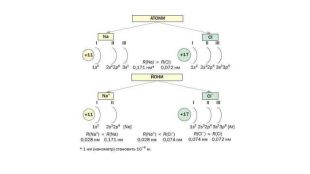
4.Електролітична дисоціація
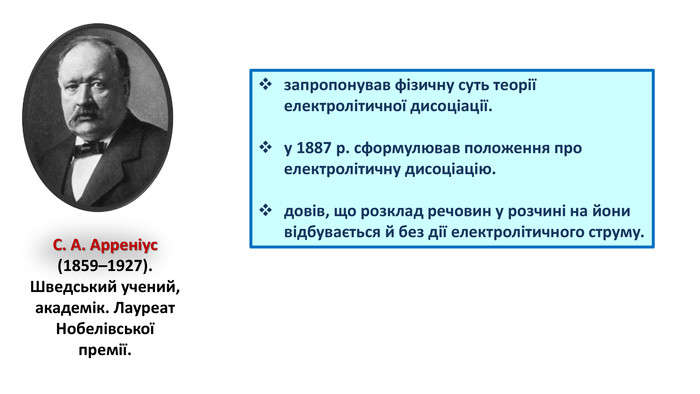
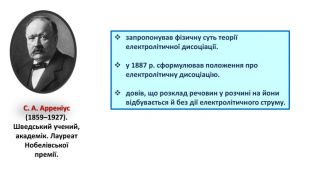
5. С.А. Арреніус
6. Теорія електролітичної дисоціації
7. Підсумок. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку