Презентація "Електролітична дисоціація основ, кислот та солей"
Про матеріал
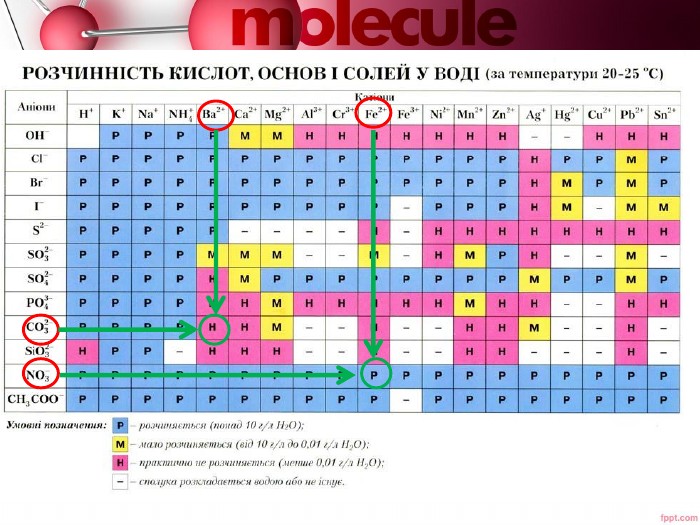
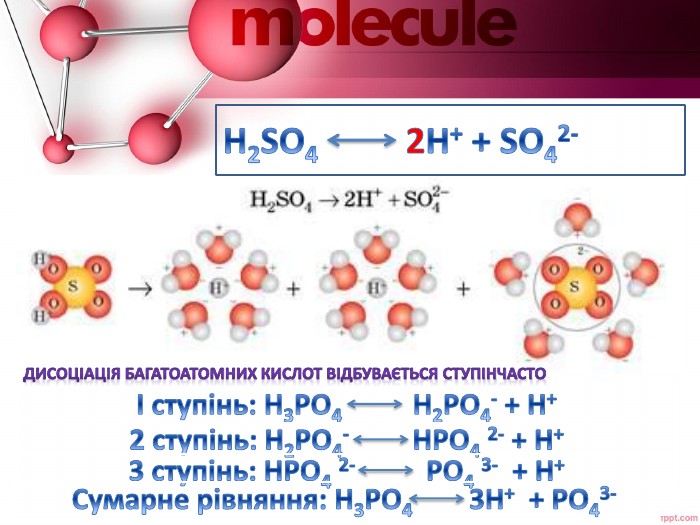
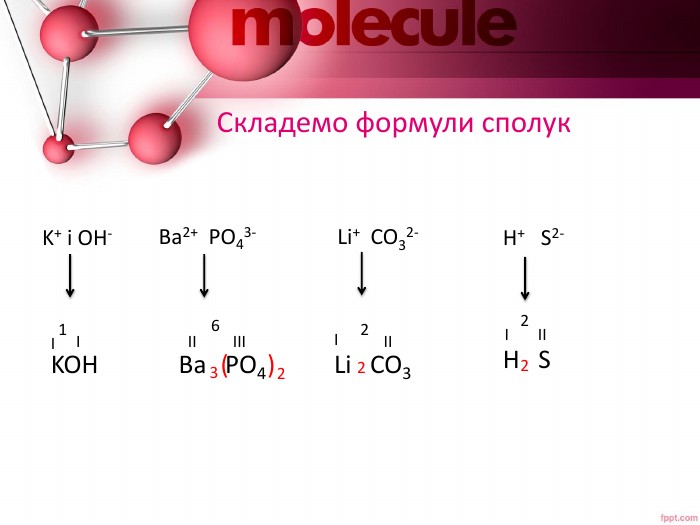
Розробка містить пояснення таких понять як - електролітична дисоціація, кислоти, основи та солі як електроліти Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку