Презентація. Феноли.







План заняття. 1. Повторення навчальної інформації за темою « Оксигеновмісні органічні сполуки. Спирти». Завдання з повторення знань. https://www.liveworksheets.com/gt1871707be 2. Ознайомлення з навчальною інформацією за § 14. Фенол. Хімія. Рівень стандарту. 10 клас. Ярошенко. https://uahistory.co/pidruchniki/yaroshenko-chemistry-10-class-2018-standard-level/15.php Тренувальні завдання https://learningapps.org/13605031 3. Ознайомлення з умовами завдань домашньої роботи. Домашнє завдання.1. Вивчити навчальну інформацію за § 14. Фенол. Хімія. Рівень стандарту. 10 клас. Ярошенко. https://uahistory.co/pidruchniki/yaroshenko-chemistry-10-class-2018-standard-level/15.php 2. Виконати письмові завдання домашньої роботи.
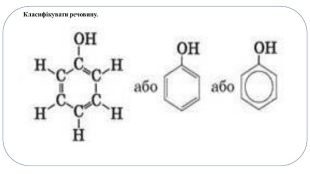
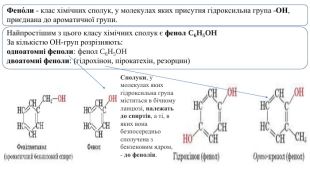
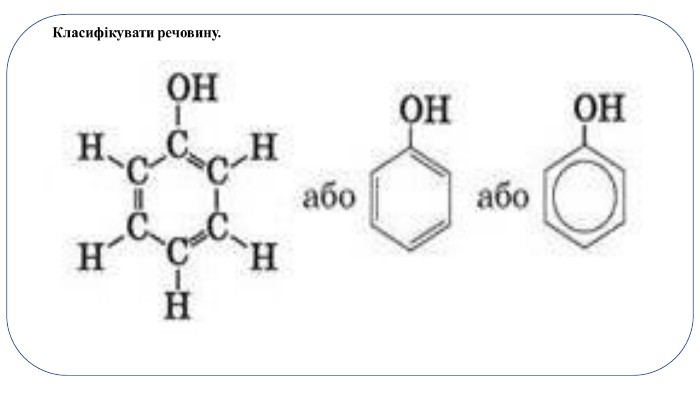
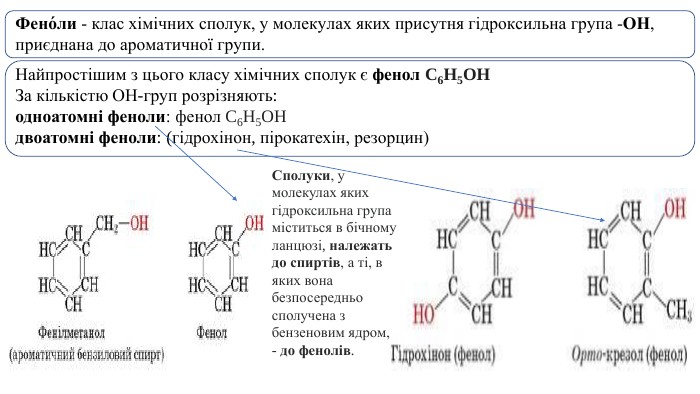
Фено́ли - клас хімічних сполук, у молекулах яких присутня гідроксильна група -OH, приєднана до ароматичної групи. Найпростішим з цього класу хімічних сполук є фенол C6 H5 OHЗа кількістю ОН-груп розрізняють:одноатомні феноли: фенол C6 H5 OH двоатомні феноли: (гідрохінон, пірокатехін, резорцин)Сполуки, у молекулах яких гідроксильна група міститься в бічному ланцюзі, належать до спиртів, а ті, в яких вона безпосередньо сполучена з бензеновим ядром, - до фенолів.
Фено́л (карболка, карболова кислота) -органічна сполука складу C6 H5 OH. За звичайних умов фенол є білою або безбарвною кристалічною речовиною із солодкуватим запахом, помірно розчинною у воді. Фенол - низькоплавка речовина (tпл = 40,8 о. С). За кімнатної температури фенол є білими або безбарвними кристалами, котрі поступово рожевіють за наявності домішок або при дії світла чи повітря. У проміжку від 0 до 65 °C фенол обмежено розчиняється у воді, а вище 65,3 змішується у будь-яких пропорціях. Він добре розчиняється у спиртах, бензені, хлороформі, етерах,В'язкість фенолу із підвищенням температури змінюється наступним чином: Температура, °C5075100 В'язкість, м. Па·с3,4371,7841,099
Токсичність. Фенол виявляє властивості протоплазматичної отрути і є небезпечним для будь-яких тканин в організмі. Типовими шляхами потрапляння фенолу до організму є проковтування, вдихання парів, а також всмоктування крізь шкіру. Оскільки він має анестетичну дію, при його контакті зі шкірою не відчувається болю, але той з'являється із часом, супроводжуючись появою опіків. При всмоктуванні крізь шкіру великої кількості фенолу відбувається ураження ЦНС і кровоносних судин, можлива поява фенольної гангрени. Пари фенолу здатні подразнювати очі та дихальні шляхи. Згідно з дослідженнями Національного інституту охорони праці (США) за стандартного 40-годинного робочого тижня присутність фенолу у повітрі є небезпечною, починаючи із концентрації 20 мг/м³. Використання фенолу в роботі вимагає застосовування захисного одягу, зокрема, окулярів і гумових рукавиць. При потраплянні фенолу на шкіру необхідно ретельно промити уражене місце водою, а згодом і поліетиленгліколем. У разі потрапляння до очей їх потрібно промити водою протягом 10 хвилин, а при вдиханні парів необхідно надати ураженому доступ до свіжого повітря
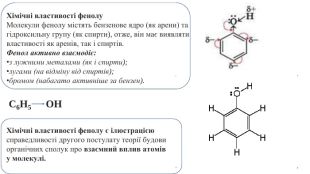
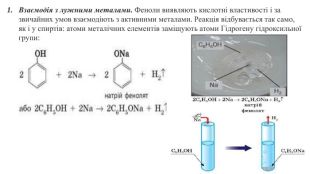
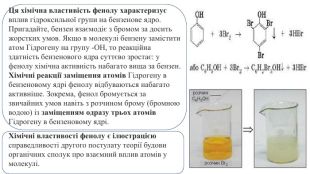
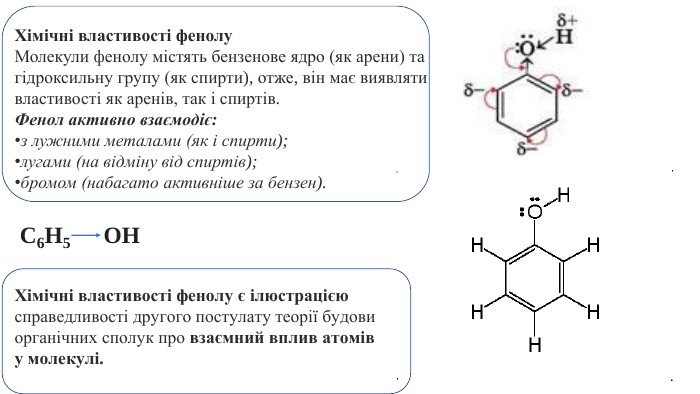
Хімічні властивості фенолу. Молекули фенолу містять бензенове ядро (як арени) та гідроксильну групу (як спирти), отже, він має виявляти властивості як аренів, так і спиртів. Фенол активно взаємодіє:з лужними металами (як і спирти);лугами (на відміну від спиртів);бромом (набагато активніше за бензен). C6 H5 OHХімічні властивості фенолу є ілюстрацією справедливості другого постулату теорії будови органічних сполук про взаємний вплив атомів у молекулі.
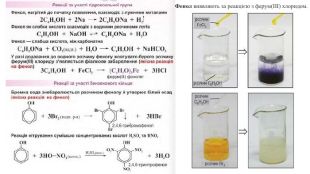
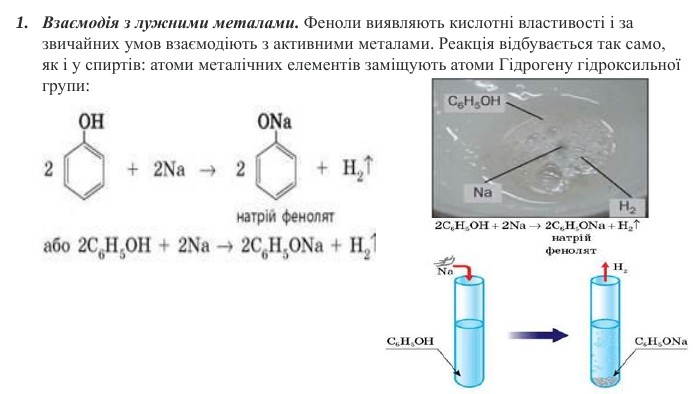
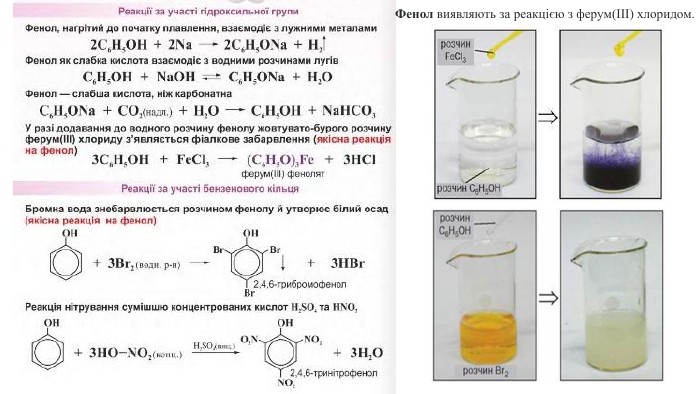
2. Взаємодія з лугами. Феноли виявляють сильніші кислотні властивості, ніж спирти, і на відміну від них взаємодіють з лугами: Здатність фенолу взаємодіяти з лугами зумовлена впливом бензенового ядра на зв'язок О-Н у гідроксильній групі. Завдяки цьому впливу зв'язок О-Н більш полярний, ніж у спиртах, і легше розривається. Унаслідок цього фенол хоч і незначною мірою, але дисоціює у водному розчині: C6 H5 OH ⇄ C6 H5 O- + Н+Але кислотні властивості фенолу настільки слабкі, що навіть така слабка кислота, як карбонатна, витісняє фенол із розчину його солей: C6 H5 ONa + CO2 + Н2 О → C6 H5 OH↓ + Na. HCO3 Виявлення фенолом кислотних властивостей надихнуло Ф. Рунге назвати фенол карболовою кислотою. Ця назва до наших часів збереглася у медицині. C6 H5 OHС6 Н5 - зветься феніл
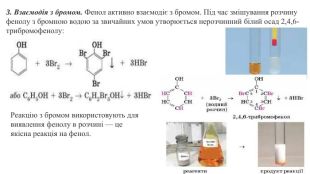
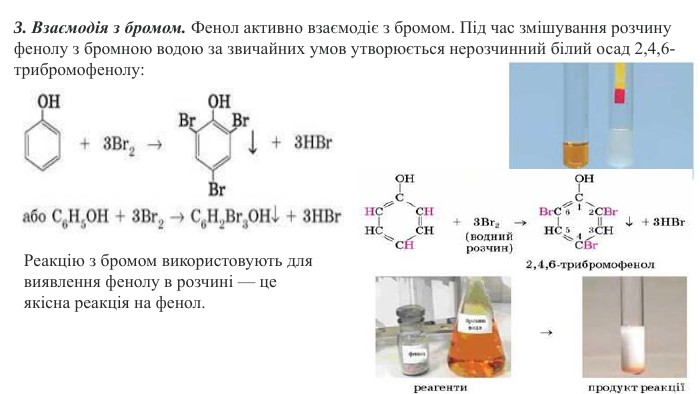
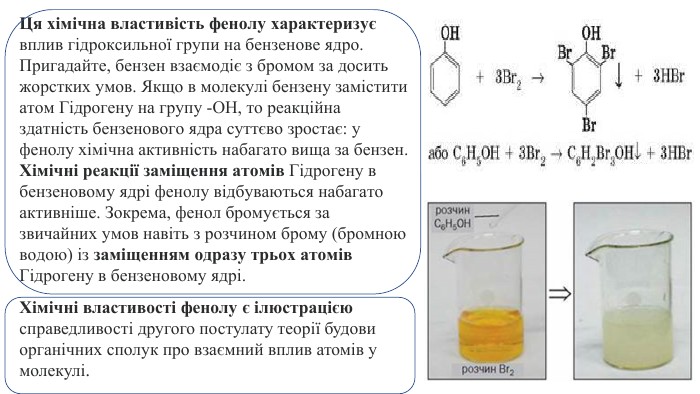
Ця хімічна властивість фенолу характеризує вплив гідроксильної групи на бензенове ядро. Пригадайте, бензен взаємодіє з бромом за досить жорстких умов. Якщо в молекулі бензену замістити атом Гідрогену на групу -ОН, то реакційна здатність бензенового ядра суттєво зростає: у фенолу хімічна активність набагато вища за бензен. Хімічні реакції заміщення атомів Гідрогену в бензеновому ядрі фенолу відбуваються набагато активніше. Зокрема, фенол бромується за звичайних умов навіть з розчином брому (бромною водою) із заміщенням одразу трьох атомів Гідрогену в бензеновому ядрі. Хімічні властивості фенолу є ілюстрацією справедливості другого постулату теорії будови органічних сполук про взаємний вплив атомів у молекулі.
Застосування. Фенол було вперше виділено з кам’яновугільної смоли в першій половині ХІХ ст. Його застосування тісно пов’язане з розвитком синтетичної органічної хімії. Фенол є вихідною речовиною для виробництва барвників, лікувальних засобів, пластичних мас, вибухових речовин. До останніх належить розглянутий вище тринітрофенол, або пікринова кислота. Фенол має антисептичні властивості, що їх було виявлено ще у другій половині ХІХ ст. Завдяки цьому розчин фенолу (5%-й) використовують для знезаражування приміщень, хірургічних інструментів, його добавляють до деяких сортів мила, ним протруюють деревину, щоб запобігти її гниттю. Дезінфікувальна дія фенолу полягає в тому, що під його впливом відбувається руйнування білків (вони згортаються), а через це припиняється життєдіяльність бактерій. Фенол - токсична речовина, він може спричинити опік шкіри. Оскільки фенол використовують у різних галузях промисловості, то разом з іншими промисловими викидами він потрапляє у стічні води, тим самим забруднюючи довкілля та впливаючи на екологічну рівновагу. Щоб запобігти цьому, фенол окиснюють до нешкідливих речовин або видаляють за допомогою розчинників.
Стисло про основне• Фенол С6 Н5 ОН - представник окремого класу оксигеновмісних сполук - фенолів, у молекулах яких гідроксильна група сполучена з атомом Карбону бензенового кільця.• Фенол - це тверда безбарвна речовина, що має характерний запах й обмежено розчиняється у воді.• Фенол у хімічних реакціях активніший за спирти. Завдяки взаємному впливу бензенового кільця й гідроксильної групи атоми Гідрогену бензенового кільця й гідроксильної групи стають більш рухливими й більш реакційно здатними в хімічних реакціях.• Як і спирти, фенол вступає в реакцію заміщення з металічним натрієм та іншими лужними металами.• Вплив бензенового кільця на характеристичну групу ОН приводить до послаблення зв'язку між атомами Оксигену й Гідрогену, і фенол виявляє кислотні властивості, зокрема реагує з лугами.


про публікацію авторської розробки
Додати розробку